UMA ABORDAGEM TERAPÊUTICA
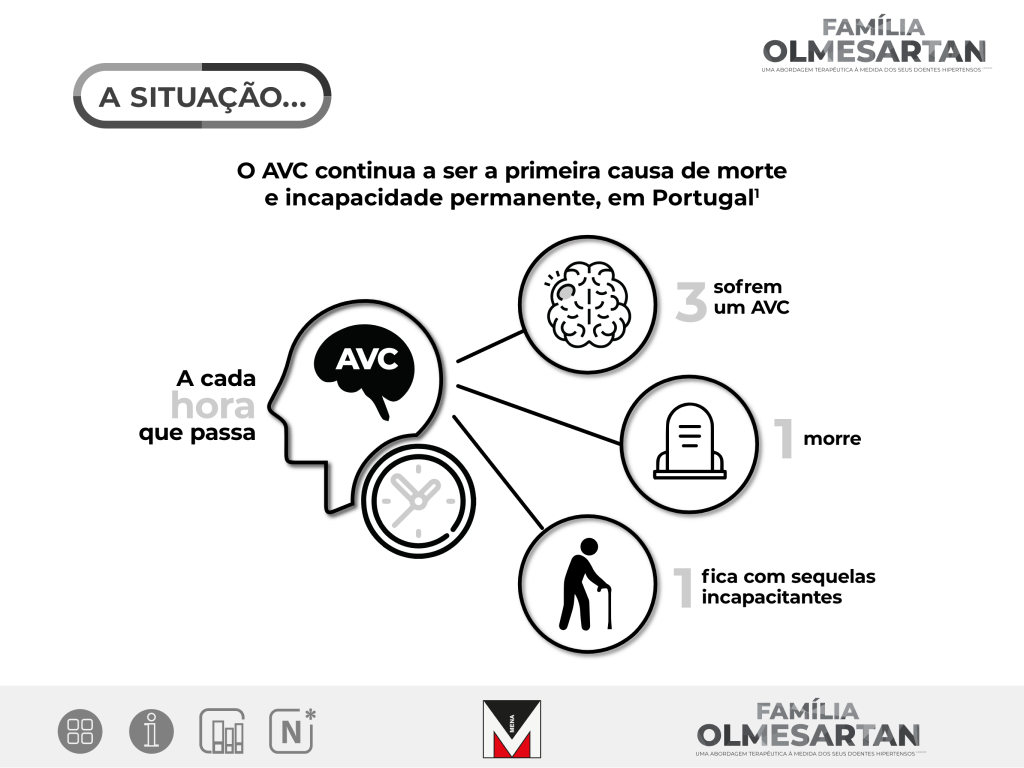
e incapacidade permanente, em Portugal1

UMA ABORDAGEM TERAPÊUTICA








UMA ABORDAGEM TERAPÊUTICA
















O risco de
descontinuação
atinge o seu valor
mínimo para
os
ARAII



Os estudos observados
sugerem que existem
diferenças na adesão à
terapêutica para
diferentes classes de
anti-hipertensores.
















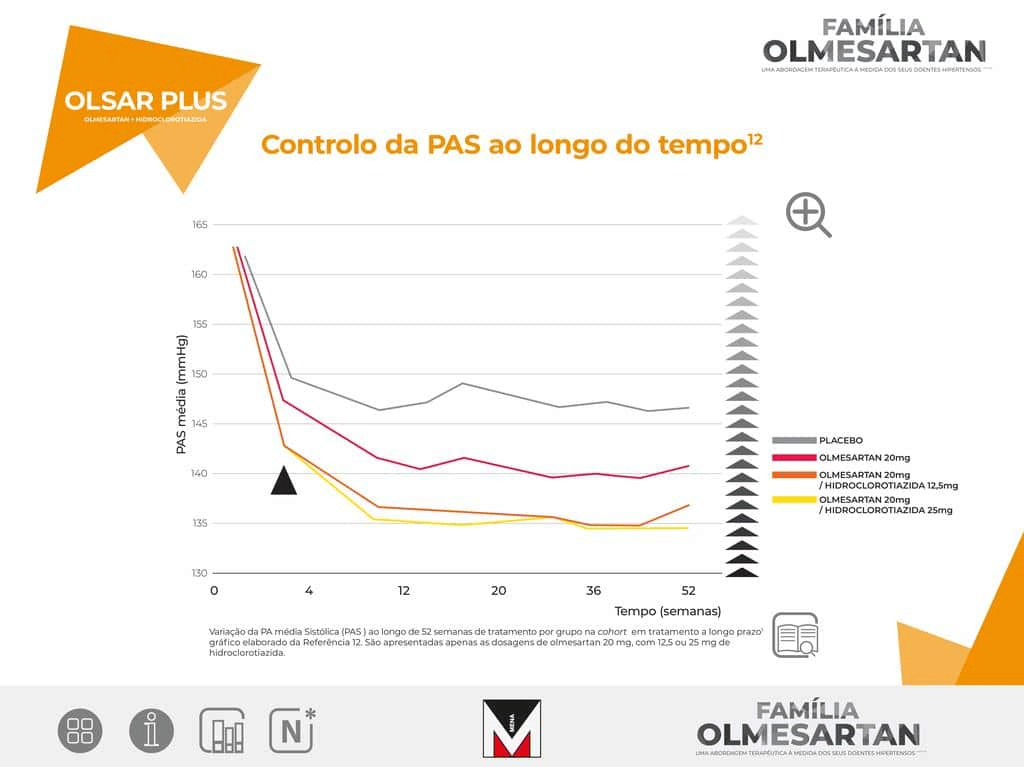
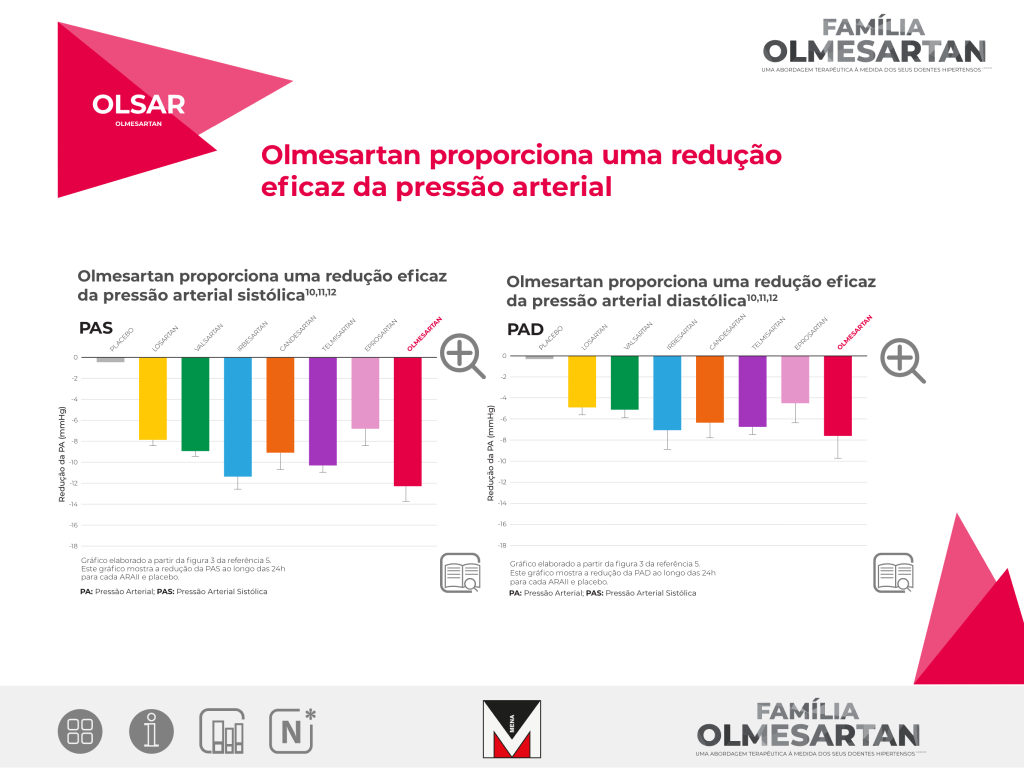
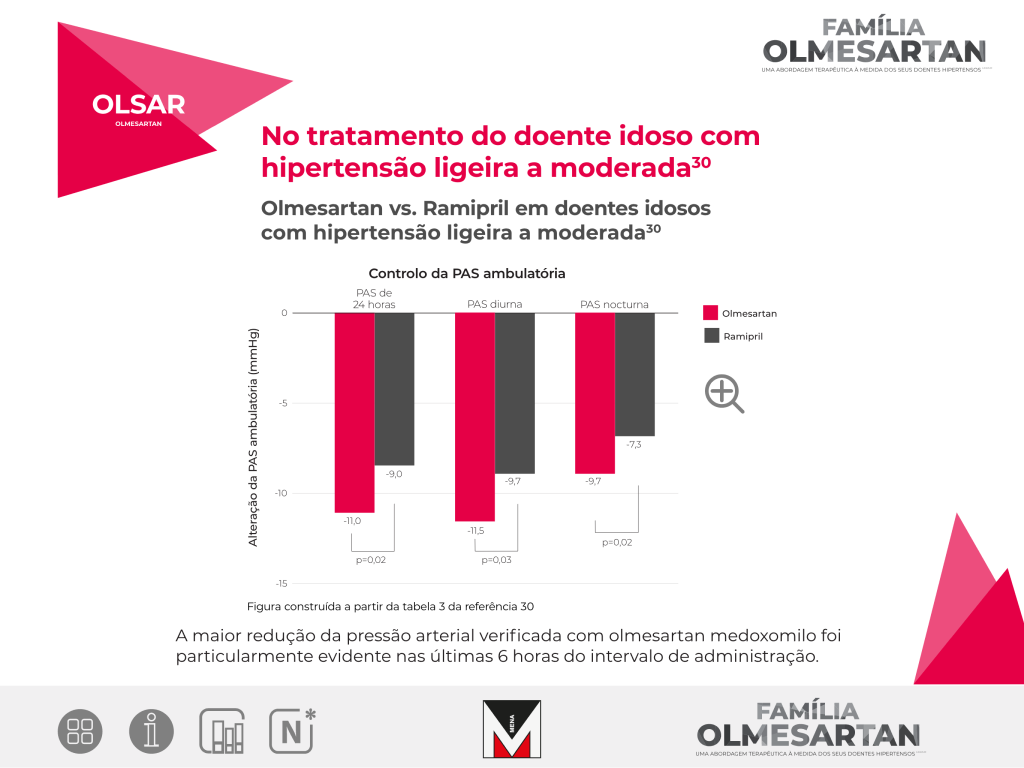
A maior redução da pressão arterial, verificada com olmesartan medoxomilo, foi particularmente evidente nas últimas 6 horas do intervalo de administração.
3/3



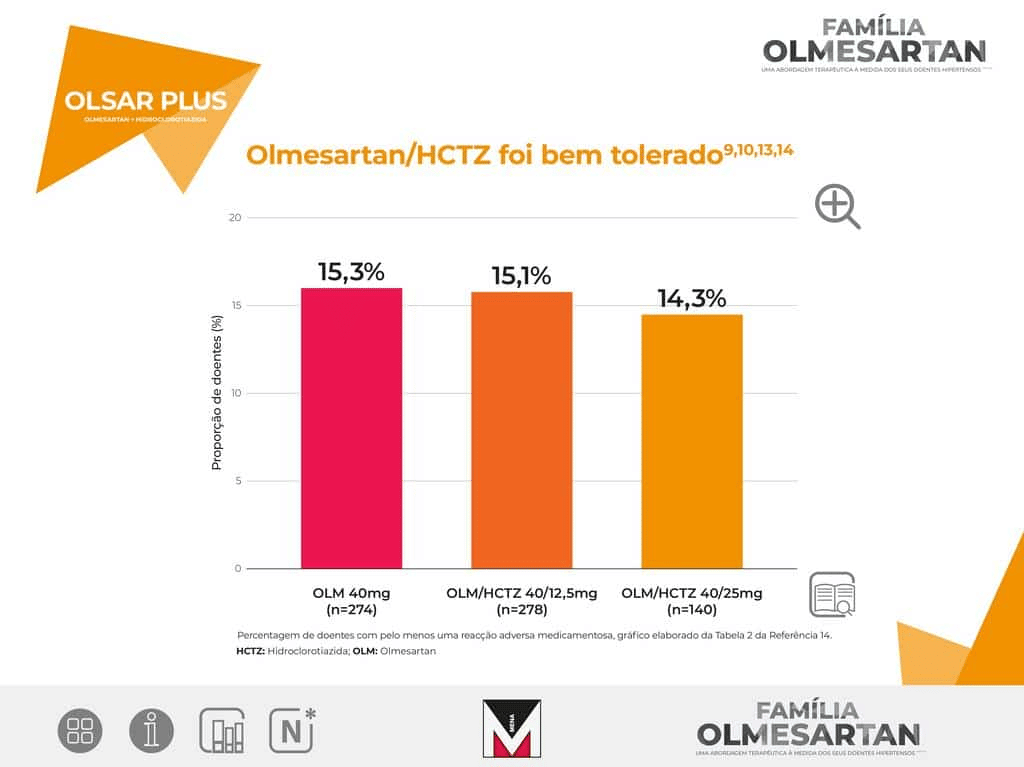
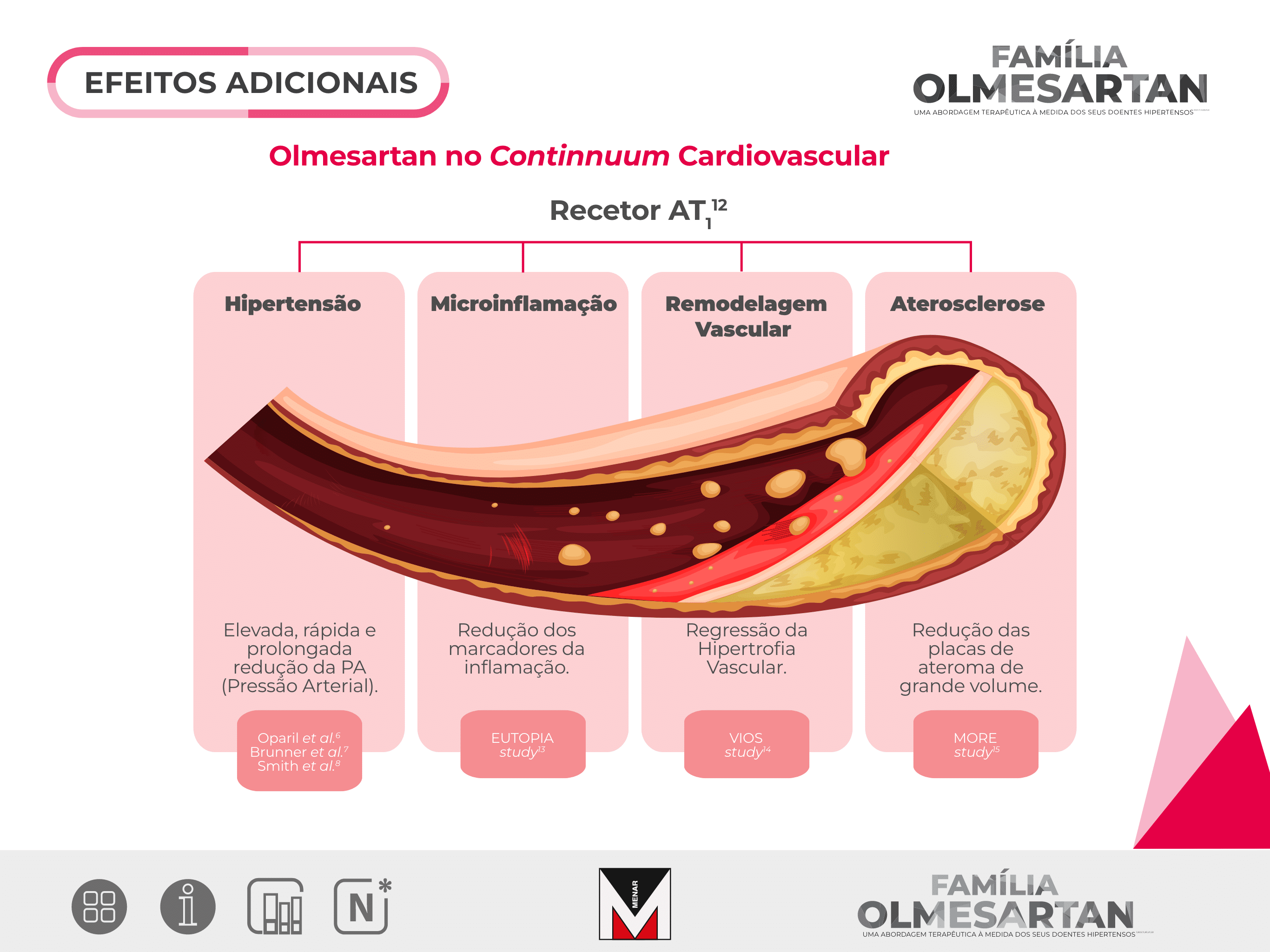
Olmesartan proporciona um controlo eficaz, prolongado e com um perfil de tolerabilidade favorável da hipertensão em doentes idosos com hipertensão essencial sistólica e diastólica ou hipertensão sistólica isolada.
Olmesartan poderá ser considerado uma opção eficaz e útil entre os tratamentos medicamentosos de primeira linha para doentes idosos com hipertensão arterial essencial.








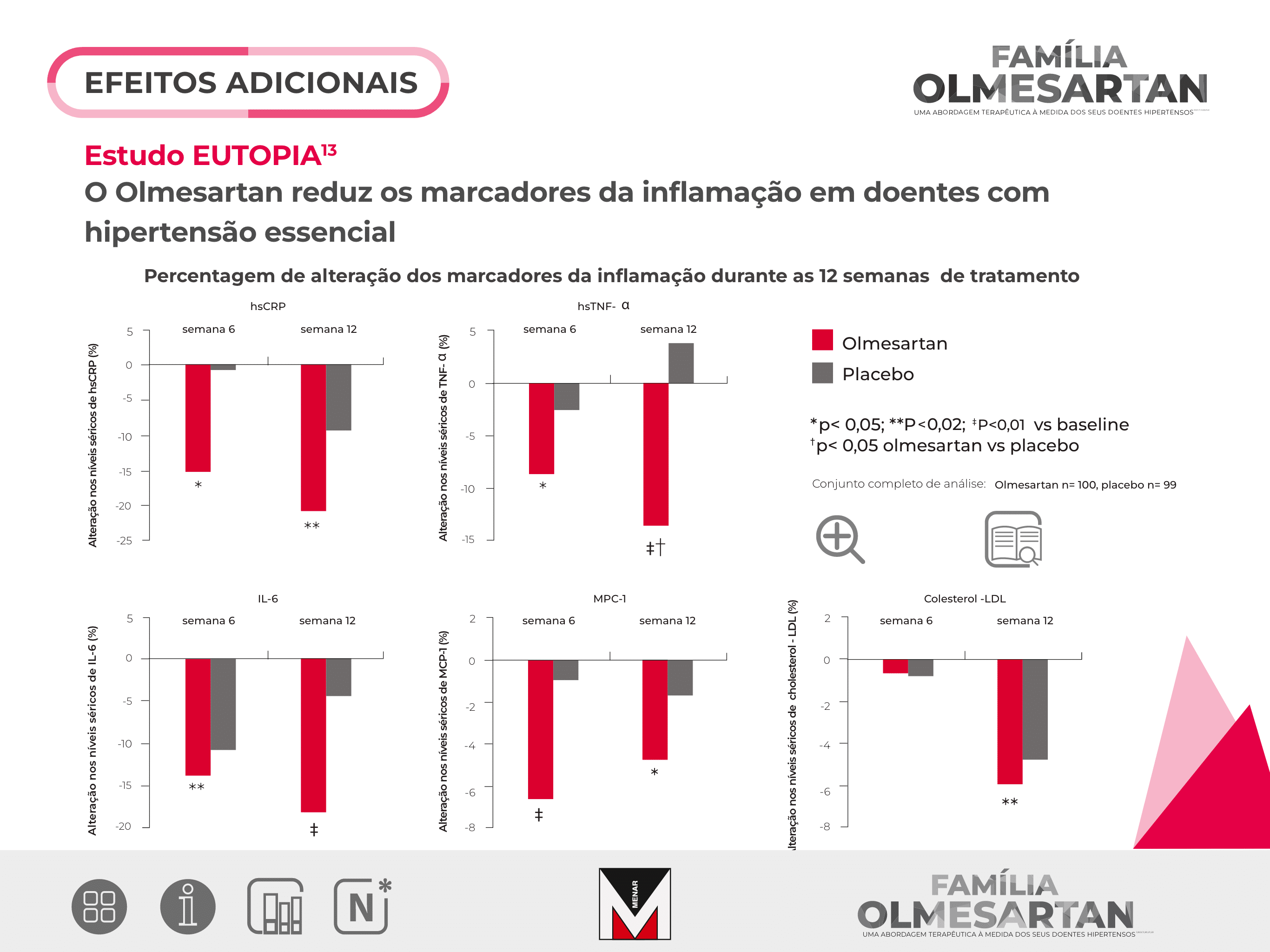
Percentagem de alteração dos marcadores da inflamação durante as 12 semanas de tratamento


*p< 0,05; **P<0,02; ‡P<0,01 vs baseline
†p< 0,05 olmesartan vs placebo
Conjunto completo de análise: Olmesartan n= 100, placebo n= 99




4/4



O tratamento com Olmesartan melhorou as anomalias estruturais nas artérias de resistência de doentes com hipertensão, com parâmetros próximos dos medidos em voluntários normotensos.
O mesmo não aconteceu no grupo tratado com atenolol, apesar da redução semelhante da pressão arterial.




Alteração média do volume da placa
ao longo do tempo em doentes tratados
com Olmesartan ou atenolol

*P= 0.044 vs baseline, 0.083 vs atenolol
**P= 0.036 vs baseline, 0.032 vs atenolol
***P= 0.014 vs baseline, 0.023 vs atenolol














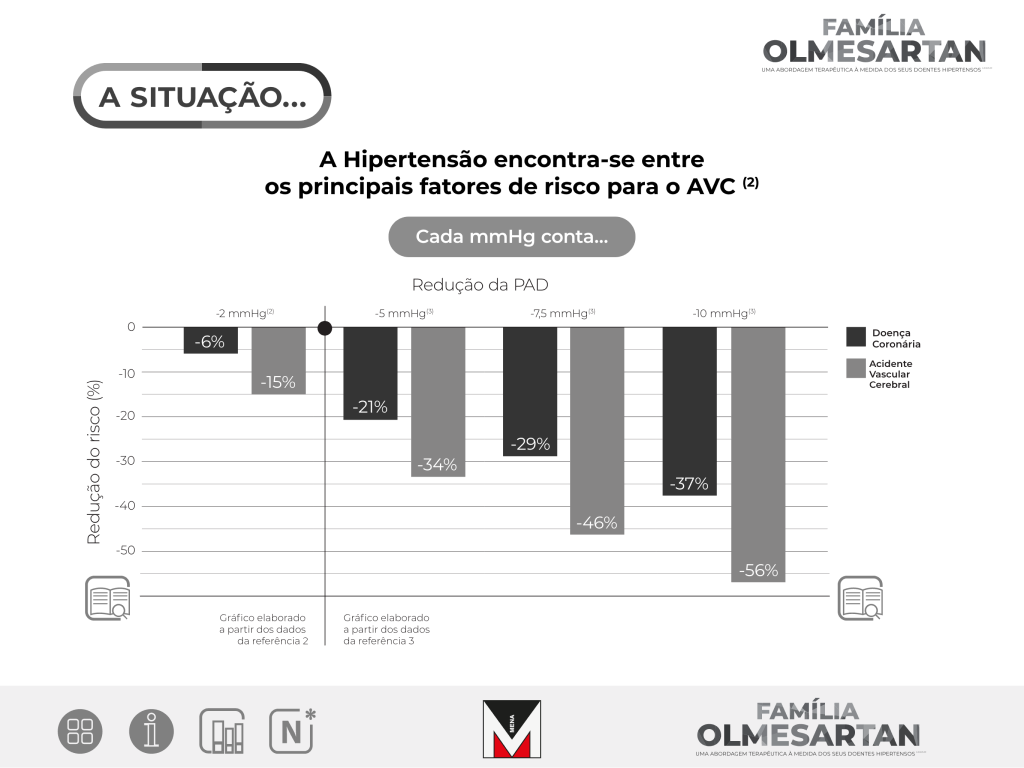
Objetivo2: Estudar o impacto de uma pequena redução na pressão arterial diastólica (PAD), na incidência de doença coronária (DC) e acidente vascular cerebral (AVC), como a potencialmente alcançada por uma população a partir das modificação do estilo de vida.
Desenho do estudo: Dados publicados a partir do estudo Framingham Heart, um estudo de cohort longitudinal, e a partir do National Health and Nutrition Examination Survey II, um questionário populacional, foram utilizados para avaliar o impacto de uma estratégia alargada à população que visava reduzir a pressão arterial diastólica numa média de 2 mmHg numa população que incluía indivíduos normotensos.
Resultados: Os resultados da análise dos dados de estudos observacionais e estudos randomizados sugerem que uma redução de 2 mmHg na PAD resultariam numa redução de 17% na prevalência da hipertensão bem como numa redução de 6% no risco de DC e numa redução de 15% no risco de AVC e acidentes isquémicos transitórios.
Conclusões: Uma pequena redução de 2 mmHg na PAD na distribuição média da população, em conjunto com o tratamento médico, pode ter um grande impacto na saúde pública no número de doença coronária e acidentes vasculares cerebrais que se conseguem prevenir.

A associação da pressão arterial diastólica (PAD) com o Acidente Vascular Cerebral (AVC) e com a Doença Coronária (DC) foi investigada em 9 estudos observacionais major, prospetivos: total de 420.000 indivíduos, 843 acidentes vasculares cerebrais e 4856 eventos coronários, 6-25 (média 10) anos de follow up.16
Os resultados combinados demonstraram associações positivas, contínuas e aparentemente independentes, sem heterogeneidade no efeito, entre estudos. Depois da correção para o viés da diluição da regressão,diferenças prolongadas na PAD habitual de 5, 7.5 e 10 mmHg, para uma redução de 34%, 46% e 56% no acidente vascular cerebral e uma redução de 21%, 29% e 37%, na Doença Coronária.
Os resultados da PAD sugerem que, para a grande maioria das pessoas, tanto convencionalmente designadas de “hipertensas” como “normotensas”, uma pressão arterial inferior pode eventualmente conferir um menor risco de doença vascular.



Objetivo do estudo: Avaliar as tendências de prescrição, determinantes e altura da
descontinuação e/ou mudanças na terapêutica anti-hipertensora, numa cohort de doentes
hipertensos, a viverem em Pavia, uma cidade do norte de Itália.
Metodologia: A cohort incluiu 61493 doentes com idade igual ou superior a 18
anos,
a tomarem pela primeira vez fármacos anti-hipertensores {monoterapia; associações fixas ou
associações livres) durante o período de 2003 a 2006. Os doentes foram classificados como
persistentes se 12 meses após o início do tratamento, eles continuavam a tomar regularmente
a
terapêutica {o mesmo medicamento = “o mesmo utilizador da terapêutica”; se foram adicionados
um
ou mais fármacos = utilizadores add-on da terapêutica; fármacos diferentes =
“seguidores”).
De outra forma, eles foram classificados como “ não-persistentes” se pararam a terapêutica
após
a primeira prescrição = utilizadores ocasionais; pararam a terapêutica precocemente =
descontinuadores; tomavam os fármacos de uma forma errática = utilizadores intermitentes.
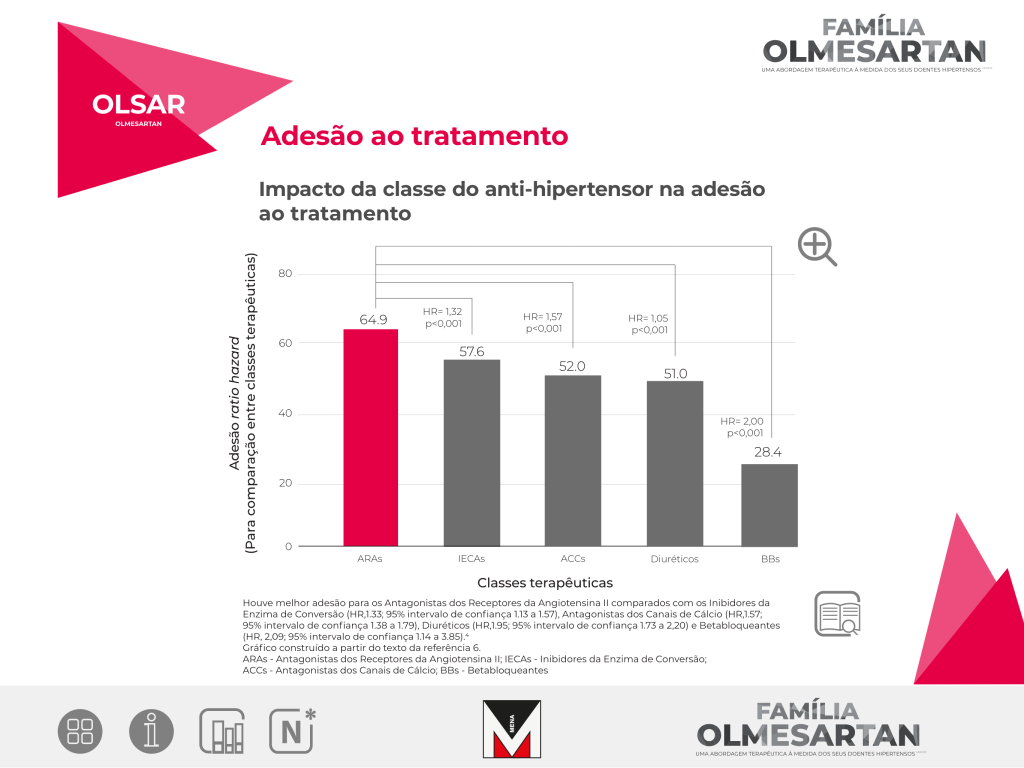
Objetivo: quantificar a associação entre a classe de anti-hipertensores e a adesão ao
tratamento no contexto clínico.
Métodos e Resultados: Os estudos foram identificados através de uma pesquisa
sistemática
de artigos publicados em Inglês nas bases de dados computorizadas até 1 de fevereiro de
2009. Os
estudos foram incluídos se avaliavam a adesão aos anti-hipertensores, dados de levantamento
dos
medicamentos e se dispunham de dados para cálculo do risco relativo de adesão e a sua
variância.
Foi usado o modelo dos efeitos aleatórios da variância inversa ponderada, para recolher os
resultados. O hazard ratio (HR) e os odd ratio, foram recolhidos
separadamente, e
os HR foram selecionados como outcome primário. Dezassete estudos cumpriram o critério de
inclusão.
O agrupamento dos dados da média da adesão por classe de fármacos, variou entre 28% para os
betabloqueantes e 65% para os inibidores dos recetores da Angiotensina II.



Revisão sistemática de estudos com monitorização de pressão arterial em ambulatório durante 24 horas que avaliou a atividade anti-hipertensora dos Antagonistas dos Recetores AT1 da Angiotensina II (ARA II) e os fatores que determinaram esta atividade. O grupo de estudo final continha 36 publicações, com um total de 47 cohorts de doentes a receberem ARA II em monoterapia, 10 com placebo, 10 com amlodipina e 5 com enalapril.
Para cada grupo, o número final de doentes incluídos na análise foi 7040 com ARA II em monoterapia, 601 com placebo, 1067 com amlodipina e 606 com enalapril.5

Revisão sistemática de estudos com monitorização de pressão arterial em ambulatório durante 24 horas que avaliou a actividade anti-hipertensora dos Antagonistas dos Receptores AT1 da Angiotensina II (ARA II) e os factores que determinaram esta actividade.
O grupo de estudo final continha 36 publicações, com um total de 47 cohorts de doentes a receberem ARA II em monoterapia, 10 com placebo, 10 com amlodipina e 5 com enalapril. Para cada grupo, o número final de doentes incluídos na análise foi 7040 com ARA II em monoterapia, 601 com placebo, 1067 com amlodipina e 606 com enalapril.5

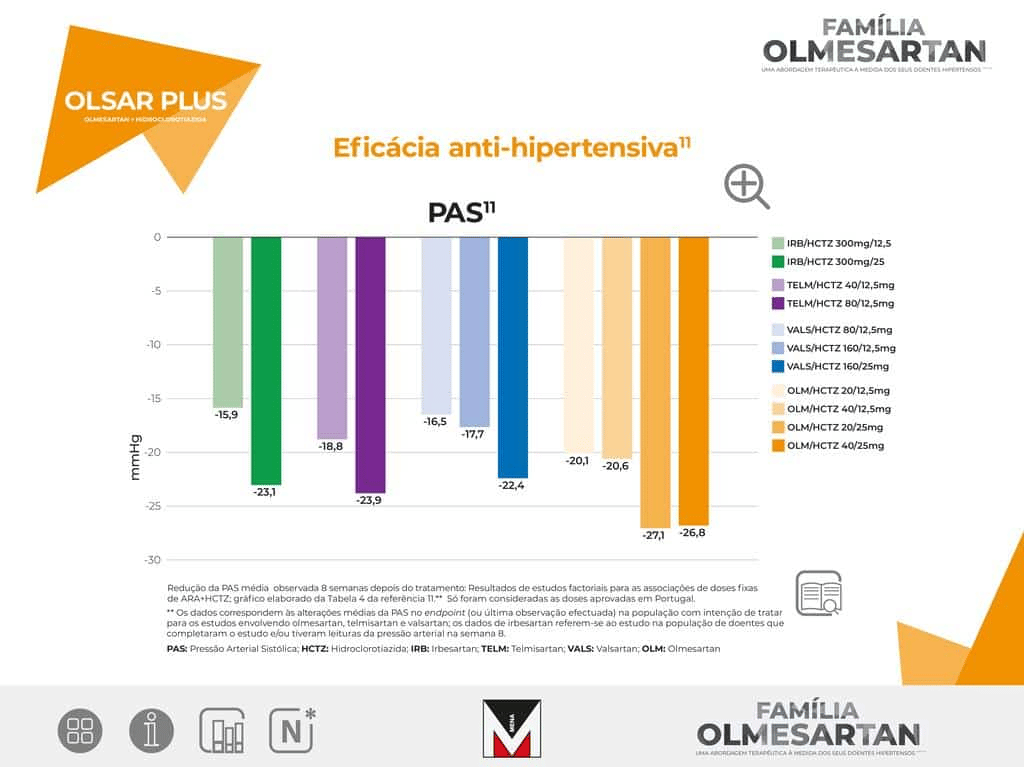
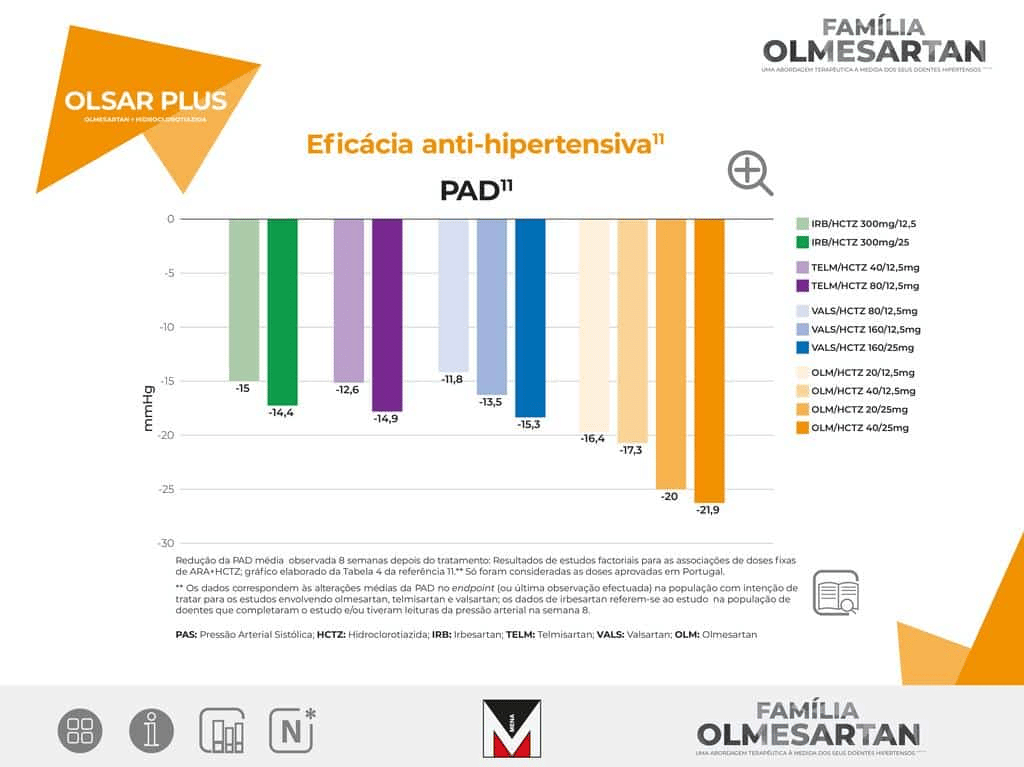
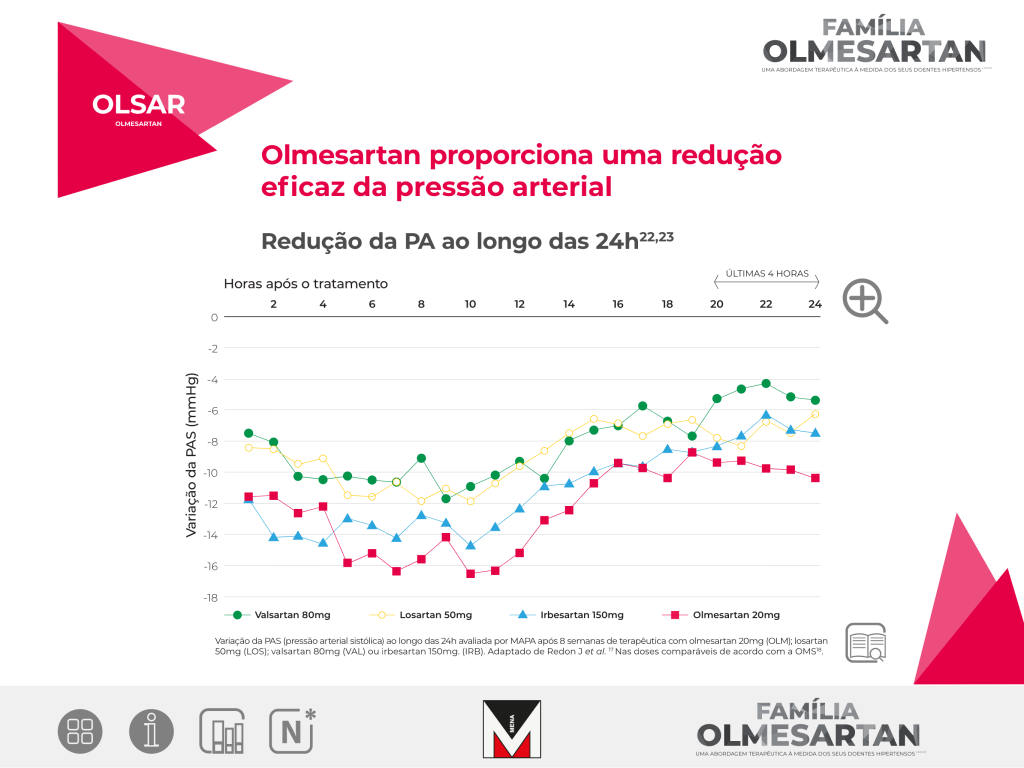
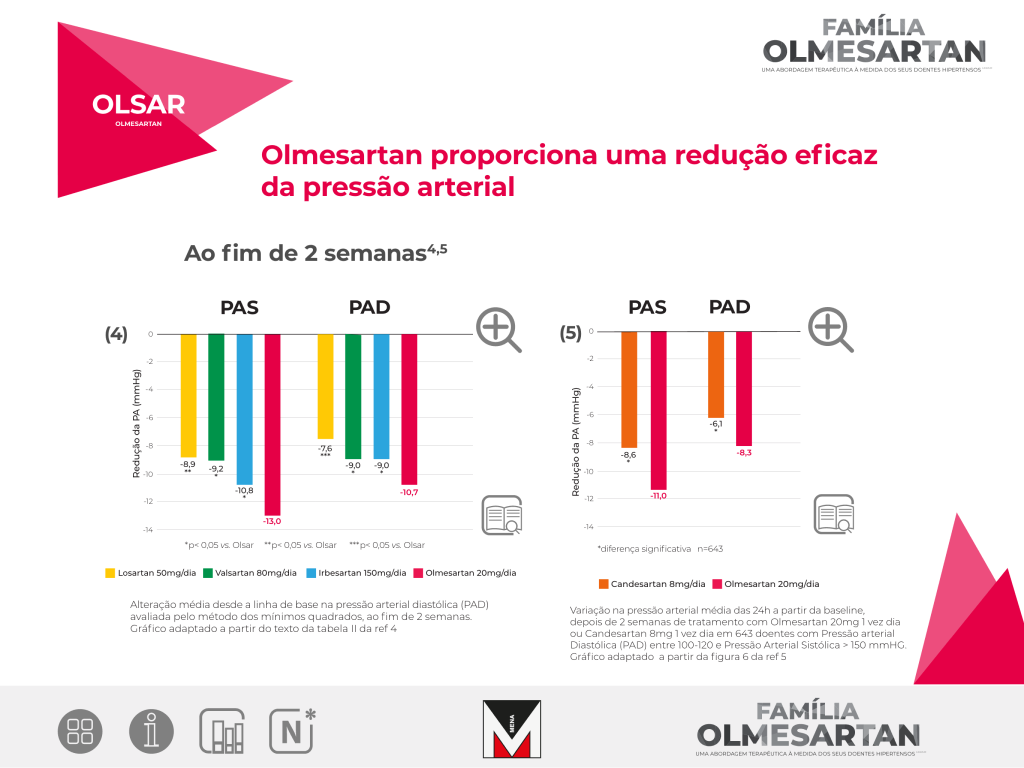
6 Estudo multicêntrico, randomizado, duplamente cego, de comparação direta da eficácia anti-hipertensora de Olmesartan 20mg (uma vez/dia) com Losartan 50mg (uma vez/dia), Valsartan 80mg (uma vez/dia) e Irbesartan 150mg (uma vez/dia) em doentes com uma PAD média entre 100-115 mmHg. Foram randomizados, para tratamento, 588 doentes. A variável de eficácia primária foi a alteração da PAD, em posição sentado, da baseline para a semana 8 da fase de tratamento ativo.
Na semana 2, a redução da PAD sentada foi significativamente maior com Olmesartan do que com Losartan, Valsartan e Irbesartan (-10,7 mmHg, versus -7,6 mmHg, -9 mmHg e -9 mmHg). O mesmo foi verdade para a redução média da pressão arterial sistólica sentada (-13 mmHg versus -8,9 mmHg, -9,2 mmHg e -10,8 mmHg).

7 Estudo randomizado, duplamente cego com grupo paralelo, multicêntrico. Comparação direta da eficácia anti-hipertensora de Olmesartan 20mg, uma vez dia, com Candesartan 8mg, uma vez dia, em 643 doentes com PAD 100-120 mmHg e PAS >150 mmHg.
Variável de eficácia primária: variação média da PAD diurna medida por Monitorização Ambulatória da PA da linha de base para as semanas 1, 2 e 8. A variação média da PAS e PAD nas 24h da linha de base para as semanas 1, 2 e 8 foi uma das variáveis de eficácia secundária.
Nas semanas 1, 2 e 8, Olmesartan foi significativamante mais eficaz do que o Candesartan na redução da PAS e PAD medida no ambulatório, ao longo das 24h, com exceção para a PAS ao fim de 8 semanas.
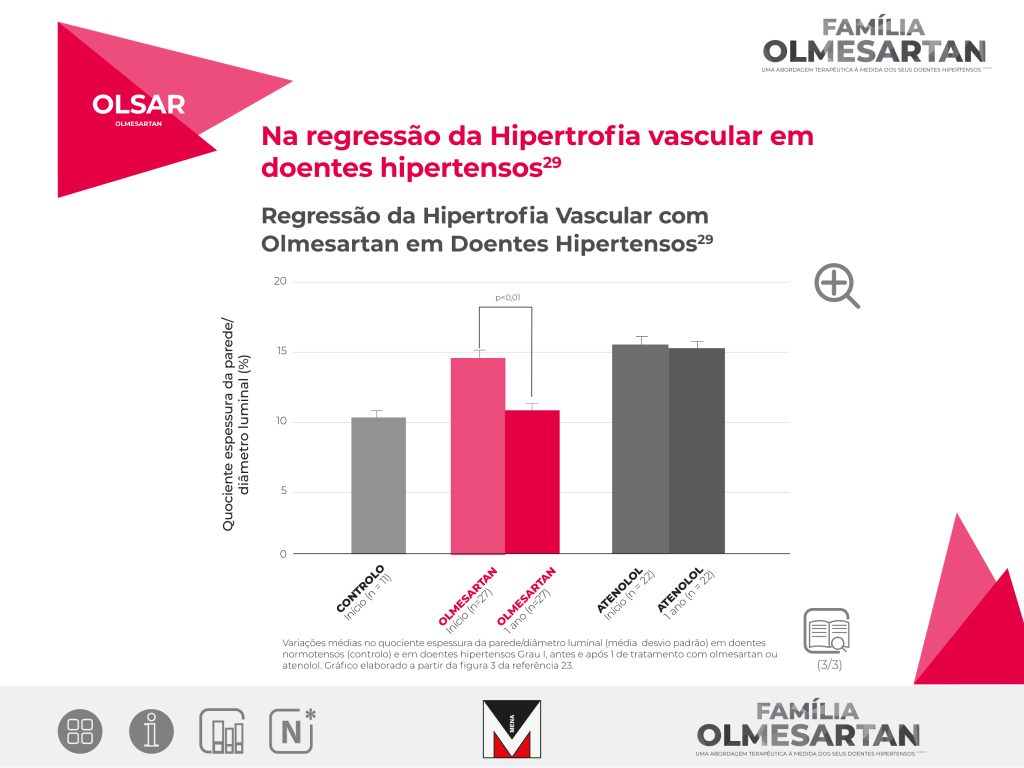
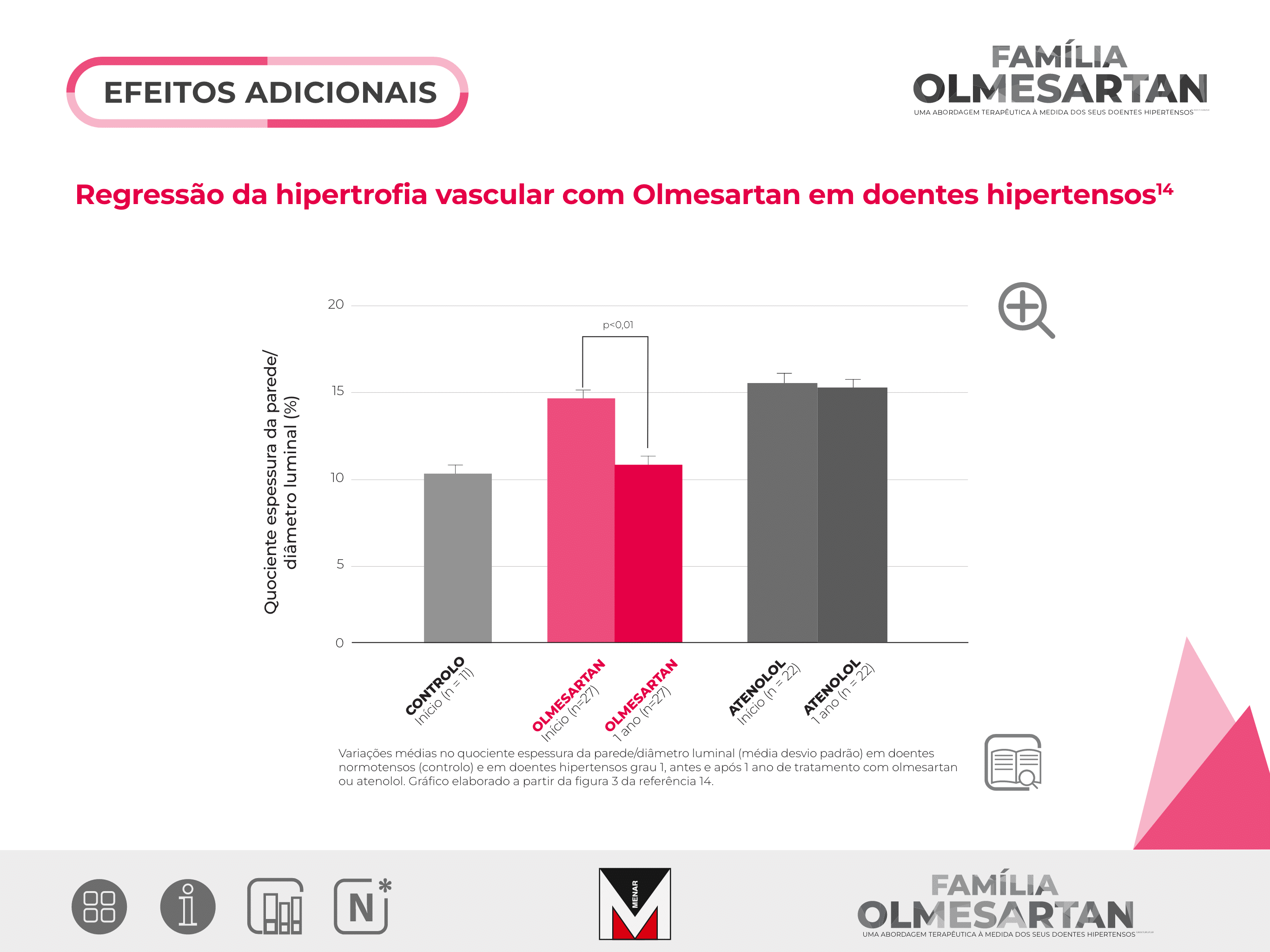
Investigar se o Olmesartan é superior ao atenolol, na alteração da remodelagem vascular, independentemente da redução da pressão arterial, em doentes hipertensos.

Estudo randomizado, controlado, aberto, com a duração de um ano, envolvendo 60 doentes com idades compreendidas entre os 38 e os 67 anos.
Os doentes foram randomizados após 4 semanas de washout, para Olmesartan 20mg e atenolol 50mg, tendo sido titulados para 40mg e 100mg e adicionado hidroclorotiazida, amlodipina ou hidralazina, para se atingir uma pressão arterial < 140/90mmHg, de acordo com o desenho do estudo apresentado na figura 1.
A resistência das artérias subcutâneas dos glúteos foi examinada no início do estudo e após um ano, através de miografia pressurizada, para se avaliar a remodelagem vascular.
As biópsias foram efetuadas em 22 doentes do grupo de atenolol, 27 doentes do grupo de Olmesartan e em 11 doentes do grupo controlo.
Após um ano de tratamento, o quociente espessura da parede/ diâmetro luminal das arteríolas diminuiu significativamente nos doentes tratados com Olmesartan (de 14,9% para 11,1%; p< 0,01).
Nos doentes tratados com atenolol não ocorreram diferenças significativas (16% para 15,5%; p=NS).
O quociente espessura da parede/ diâmetro luminal no grupo de controlo foi de 11%.




Estudo de 12 semanas (4 semanas fase run in placebo duplamente cego, seguido por fase de 8 semanas de tratamento ativo duplamente cego) aleatorizado, de grupos paralelos em 588 doentes com hipertensão essencial comparando a dose inicial de olmesartan 20 mg/dia com valsartan 80 mg/dia, losartan 50 mg/dia e irbesartan 150 mg/dia.8
A variável de eficácia primária foi a alteração na PAD desde a linha de base até à semana 8.


A maior redução da pressão arterial, verificada com olmesartan medoxomilo, foi particularmente evidente nas últimas 6 horas do intervalo de administração.

Comparar a eficácia e a tolerabilidade de olmesartan medoxomilo versus ramipril em doentes idosos com hipertensão essencial ligeira a moderada. O parâmetro de avaliação primário consistiu na alteração da pressão arterial (sistólica e diastólica) medida no consultório médico desde a linha base até à semana 12.


Estudo aleatorizado, multicêntrico, paralelo e em dupla ocultação.
Estiveram envolvidos um total de 1081 doentes, 539 no grupo de ramipril e 542 no grupo olmesartan. Um subgrupo de doentes foi submetido a uma análise de redução da pressão arterial ambulatória de 24 horas (n = 318 para olmesartan medoxomilo e n = 312 para ramipril). O estudo teve a duração de 12 semanas.
Nos doentes previamente tratados com anti-hipertensores, no momento da sua inclusão e antes da aleatorização, foi realizado um período de washout com placebo, durante duas semanas.


Percentagem de alteração dos marcadores da inflamação durante as 12 semanas de tratamento


*p< 0,05; **P<0,02; ‡P<0,01 vs baseline
†p< 0,05 olmesartan vs placebo
Conjunto completo de análise: Olmesartan n= 100, placebo n= 99


Alteração média do volume da placa
ao longo do tempo em doentes tratados
com Olmesartan ou atenolol

*P= 0.044 vs baseline, 0.083 vs atenolol
**P= 0.036 vs baseline, 0.032 vs atenolol
***P= 0.014 vs baseline, 0.023 vs atenolol
Este texto foi escrito ao abrigo do novo acordo ortográfico.




Informações Essenciais Compatíveis com o RCM
NOME DO MEDICAMENTO
Olsar 10 mg / 20 mg / 40 mg comprimidos revestidos por películaCOMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido revestido por película contém 10 mg / 20 mg / 40 mg de olmesartan medoxomilo. Excipientes com efeito conhecido: Olsar 10 mg / 20 mg / 40 mg comprimidos revestidos por película: cada comprimido revestido por película contém 61,6 mg / 123,2 mg / 246,4 mg de lactose mono-hidratada.FORMA FARMACÊUTICA
Comprimido revestido por película. Olsar 10 e 20 mg comprimidos: cor branca, forma circular, comprimidos revestidos por película com C13 e C14 gravado num dos lados, respetivamente. Olsar 40 mg comprimidos: cor branca, forma oval, comprimidos revestidos por película com C15 gravado num dos lados.INFORMAÇÕES CLÍNICAS
Indicações terapêuticas: Tratamento da hipertensão essencial em adultos. Tratamento da hipertensão em crianças e adolescentes dos 6 anos a menos de 18 anos de idade.POSOLOGIA E MODO DE ADMINISTRAÇÃO: POSOLOGIA:
Adultos: A dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia. Em doentes cuja tensão arterial não está adequadamente controlada com esta dose, a posologia de olmesartan medoxomilo pode ser aumentada para 20 mg uma vez por dia como dose ótima. Se for necessária uma maior redução da tensão arterial, a dose de olmesartan medoxomilo pode ser aumentada para um máximo de 40 mg uma vez por dia ou associar-se a uma terapêutica com hidroclorotiazida. A ação anti-hipertensora do olmesartan medoxomilo é já evidente às 2 semanas de terapêutica e o efeito máximo atinge-se cerca de 8 semanas após o início da terapêutica. Deve ter-se presente este facto quando se pondera a alteração do regime posológico em qualquer doente. Idosos (idade igual ou superior a 65 anos): Geralmente não é necessário um ajuste posológico em idosos (ver recomendações relativas à posologia em doentes com compromisso renal). Se for necessária a titulação para a dose máxima diária de 40 mg, a tensão arterial deve ser cuidadosamente monitorizada. Compromisso renal: A dose máxima em doentes com compromisso renal ligeiro a moderado (depuração da creatinina 20-60 ml/min) é de 20 mg de olmesartan medoxomilo uma vez por dia, devido à experiência limitada com dosagens mais elevadas neste grupo de doentes. Não se recomenda a utilização de olmesartan medoxomilo em doentes com compromisso renal grave (depuração da creatinina < 20 ml/min), dado que existe uma experiência limitada com este grupo de doentes. Compromisso hepático: Não são necessários ajustes das doses recomendadas em doentes com compromisso hepático ligeiro. Em doentes com compromisso hepático moderado, a dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20 mg uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático que já estão em tratamento com diuréticos e/ou outros fármacos anti-hipertensores. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave, pelo que não se recomenda a sua utilização neste grupo de doentes. Olmesartan medoxomilo não deve ser usado em doentes com obstrução biliar. População pediátrica: Crianças e adolescentes dos 6 anos a menos de 18 anos de idade: A dose inicial recomendada é de 10 mg uma vez por dia. Em crianças cuja pressão arterial não está adequadamente controlada com esta dose, a dose de olmesartan medoxomilo pode ser aumentada para 20 mg uma vez por dia. Se for necessária uma redução adicional da pressão arterial, em crianças com peso ≥ 35 kg, a dose pode ser aumentada para um máximo de 40 mg. Em crianças com peso < 35 kg, a dose diária não deve exceder os 20 mg. Outra população pediátrica: A segurança e eficácia de olmesartan medoxomilo em crianças com idade de 1 a 5 anos ainda não foram estabelecidas. Olmesartan medoxomilo não deve ser utilizado em crianças com menos de 1 ano de idade devido a preocupações com a segurança e a falta de dados neste grupo etário. Não existem dados disponíveis. Modo de administração: A fim de facilitar a adesão à terapêutica, recomenda-se que os comprimidos de Olsar sejam tomados aproximadamente à mesma hora, todos os dias, com ou sem alimentos, por exemplo ao pequeno-almoço. O comprimido deve ser engolido com uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado. Contraindicações: Hipersensibilidade à substância ativa ou a qualquer um dos excipientes mencionados. Segundo e terceiro trimestres de gravidez. Obstrução biliar. O uso concomitante de Olsar com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m2). Efeitos indesejáveis: Resumo do perfil de segurança: As reações adversas mais frequentemente notificadas durante o tratamento com Olsar são cefaleias (7,7%), sintomas do tipo gripal (4,0%) e tonturas (3,7%). Em estudos de monoterapia controlados com placebo, a única reação adversa inequivocamente relacionada com o tratamento foi a ocorrência de tonturas (incidência de 2,5% com o olmesartan medoxomilo e de 0,9% com o placebo). A incidência foi também ligeiramente superior com olmesartan medoxomilo comparativamente com placebo para hipertrigliceridemia (2,0% versus 1,1%) e para creatina-fosfoquinase aumentada (1,3% versus 0,7%). As reações adversas do Olsar em ensaios clínicos, estudos de segurança pós-autorização e notificações espontâneas estão resumidas abaixo. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas: muito frequentes (≥1/10); frequentes (≥1/100, <1 /10); pouco frequentes (≥1/1.000, <1/100); raras (≥1/10.000, <1/1.000); muito raras (<1/10.000). Doenças do sangue e do sistema linfático Trombocitopenia: Pouco frequente. Doenças do sistema imunitário Reações anafiláticas: Pouco frequente. Doenças do metabolismo e da nutrição Hipertrigliceridemia: Frequente. Hiperuricemia: Frequente. Hipercaliemia: Rara. Doenças do sistema nervoso Tonturas: Frequente. Cefaleias: Frequente. Afeções do ouvido e do labirinto Vertigens: Pouco frequente. Cardiopatias Angina de peito: Pouco frequente. Vasculopatias Hipotensão: Rara. Doenças respiratórias, torácicas e do mediastino Bronquite: Frequente. Faringite: Frequente. Tosse: Frequente. Rinite: Frequente. Doenças gastrointestinais Gastroenterite: Frequente. Diarreia: Frequente. Dor abdominal: Frequente. Náuseas: Frequente. Dispepsia: Frequente. Vómitos: Pouco frequente. Angioedema intestinal: Rara. Enteropatia semelhante a esprue: Muito rara. Afeções dos tecidos cutâneos e subcutâneos Exantema: Pouco frequente. Dermatite alérgica: Pouco frequente. Urticária: Pouco frequente. Erupção cutânea: Pouco frequente. Prurido: Pouco frequente. Angiedema: Rara. Afeções musculosqueléticas e dos tecidos conjuntivos Artrite: Frequente. Dorsalgia: Frequente. Dor esquelética: Frequente. Mialgia: Pouco frequente. Espasmos musculares: Rara. Doenças renais e urinárias Hematúria: Frequente. Infeção do trato urinário: Frequente. Insuficiência renal aguda: Rara. Insuficiência renal: Rara. Perturbações gerais e alterações no local de administração Dor: Frequente. Dor torácica: Frequente. Edema periférico: Frequente. Sintomas do tipo gripal: Frequente. Fadiga: Frequente. Edema facial: Pouco frequente. Astenia: Pouco frequente. Mal-estar: Pouco frequente. Letargia: Rara. Exames complementares de diagnóstico Aumento das enzimas hepáticas: Frequente. Aumento da ureia no sangue: Frequente. Aumento da creatina-fosfoquinase no sangue: Frequente. Aumento da creatinina no sangue: Rara. Foram notificados casos singulares de rabdomiólise em associação temporal com a toma de bloqueadores dos recetores da angiotensina II. Informação adicional em populações especiais: População pediátrica A segurança do olmesartan medoxomilo foi monitorizada em 361 crianças e adolescentes, com idades entre 1-17 anos em 2 ensaios clínicos. Embora a natureza e gravidade dos acontecimentos adversos sejam semelhantes às dos adultos, a frequência dos seguintes acontecimentos adversos é mais elevada nas crianças: - A epistaxe é um acontecimento adverso frequente em crianças (ou seja ≥ 1/100, <1 /10) que não tem sido notificado em adultos. - Durante as 3 semanas do ensaio de dupla ocultação, a incidência de tonturas e de cefaleias emergentes do tratamento quase duplicou em crianças com 6-17 anos de idade no grupo de dose elevada de olmesartan medoxomilo. O perfil de segurança global para o olmesartan medoxomilo em doentes pediátricos não difere de forma significativa do perfil de segurança em adultos. Idosos (idade igual ou superior a 65 anos), a frequência de hipotensão aumenta ligeiramente, de rara para pouco frequente. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. (tel: +351 21 798 73 73; Linha do medicamento: 800222444 (gratuita); Fax: +351 21 798 73 97; E-mail: farmacovigilancia@infarmed.pt; internet: http://www.infarmed.pt/web/infarmed/submissaoram. Para mais informações deverá contactar o titular da autorização de introdução no mercado - Menarini International Operations Luxembourg S.A.. Representante: A. Menarini Portugal-Farmacêutica, S.A. Informações revistas em Janeiro de 2025. Para mais informações deverá contactar o representante local do Titular da Autorização de Introdução no Mercado: A. Menarini Portugal – Farmacêutica, S.A. Medicamento sujeito a receita médica. Medicamento Comparticipado - Escalão B. Ref ª 07/2025PLUS Informações essenciais compatíveis com o RCM
NOME DO MEDICAMENTO:
Olsar Plus 20 mg/12,5 mg, comprimidos revestidos por película. Olsar Plus 20 mg/25 mg, comprimidos revestidos por película.COMPOSIÇÃO QUALITATIVA E QUANTITATIVA:
Olsar Plus 20 mg/12,5 mg comprimidos revestidos por película: Cada comprimido revestido por película contém 20 mg de olmesartan medoxomilo e 12,5 mg de hidroclorotiazida. Olsar Plus 20 mg/25 mg comprimidos revestidos por película: Cada comprimido revestido por película contém 20 mg de olmesartan medoxomilo e 25 mg de hidroclorotiazida. Excipientes com efeito conhecido: Olsar Plus 20 mg/12,5 mg comprimidos revestidos por película: cada comprimido revestido por película contém 110,7 mg de lactose mono-hidratada. Olsar Plus 20 mg/25 mg comprimidos revestidos por película: cada comprimido revestido por película contém 98,2 mg de lactose mono-hidratada.FORMA FARMACÊUTICA:
Comprimidos revestidos por película. Olsar Plus 20 mg/12,5 mg comprimidos revestidos por película: comprimidos revestidos por película de cor alaranjada, forma redonda, de 8,5 mm com C22 gravado num dos lados. Olsar Plus 20 mg/25 mg comprimidos revestidos por película: comprimidos revestidos por película de cor rosada, forma redonda, de 8,5 mm com C24 gravado num dos lados.INFORMAÇÕES CLÍNICAS:
Indicações terapêuticas: Tratamento da hipertensão essencial. A combinação de dose fixa de Olsar Plus está indicada em doentes adultos cuja tensão arterial não está adequadamente controlada com olmesartan medoxomilo em monoterapia.Posologia e modo de administração: Posologia:
Adultos O Olsar Plus não deve ser utilizado como terapêutica inicial, mas em doentes cuja tensão arterial não esteja adequadamente controlada com 20 mg de olmesartan medoxomilo em monoterapia. Olsar Plus é administrado uma vez por dia, com ou sem alimentos. Quando clinicamente apropriado, pode ser considerada uma mudança direta da monoterapia com 20 mg de olmesartan medoxomilo para a combinação fixa, tendo em atenção que o efeito anti-hipertensor do olmesartan medoxomilo atinge o seu máximo cerca de 8 semanas após o início do tratamento. Recomenda-se a titulação da dose dos componentes individuais: Olmesartan medoxomilo 20 mg/hidroclorotiazida 12,5 mg pode ser administrado em doentes cuja tensão arterial não esteja adequadamente controlada pela monoterapia otimizada com olmesartan medoxomilo 20 mg. Olmesartan medoxomilo 20 mg/hidroclorotiazida 25 mg pode ser administrado em doentes cuja tensão arterial não esteja adequadamente controlada com olmesartan medoxomilo 20 mg/hidroclorotiazida 12,5 mg. Idosos (idade igual ou superior a 65 anos) Em idosos a dosagem recomendada da combinação é idêntica à usada nos adultos. Compromisso renal Quando o Olsar Plus é utilizado em doentes com compromisso renal ligeiro a moderado (depuração da creatinina 30 – 60 ml/min.), recomenda-se a monitorização periódica da função renal. O Olsar Plus está contraindicado em doentes com compromisso renal grave (depuração da creatinina < 30 ml/min.). Compromisso hepático Olsar Plus deve ser usado com precaução em doentes com compromisso hepático ligeiro a moderado. Em doentes com compromisso hepático moderado, a dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder 20 mg uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático que estão em tratamento com diuréticos e/ou outros fármacos anti-hipertensores. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave. Olsar Plus não deve ser usado em doentes com compromisso hepático grave, colestase e obstrução biliar. População pediátrica A segurança e eficácia de Olsar Plus em crianças e adolescentes com idade inferior a 18 anos não foram ainda estabelecidas. Não existem dados disponíveis. Modo de administração: O comprimido deve ser engolido com uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser tomado à mesma hora todos os dias. Contraindicações: Hipersensibilidade às substâncias ativas, a qualquer um dos excipientes ou a outras substâncias derivadas da sulfonamida (dado que a hidroclorotiazida é um fármaco derivado da sulfonamida). Compromisso renal grave (depuração da creatinina < 30 ml/min). Hipocaliemia refractária, hipercalcemia, hiponatremia e hiperuricemia sintomática. Compromisso hepático grave, colestase e afeções biliares obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante de Olsar Plus com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m2). Efeitos indesejáveis: As reações adversas mais frequentemente notificadas durante o tratamento com Olsar Plus são cefaleias (2,9%), tonturas (1,9%) e fadiga (1,0%). A hidroclorotiazida pode causar ou exacerbar uma depleção de volume que pode levar a desequilíbrio eletrolítico. Em ensaios clínicos envolvendo 1155 doentes tratados com combinações de olmesartan medoxomilo e hidroclorotiazida nas dosagens de 20 mg/12,5 mg ou 20 mg/25 mg e 466 doentes tratados com placebo durante períodos até 21 meses, a frequência global de reações adversas na terapêutica combinada de olmesartan medoxomilo e hidroclorotiazida foi similar à terapêutica com placebo. As interrupções devidas a reações adversas foram também similares para olmesartan medoxomilo/hidroclorotiazida 20 mg/12,5 mg – 20 mg/25 mg (2%) e placebo (3%). A frequência global de reações adversas com olmesartan medoxomilo/hidroclorotiazida relativamente ao placebo aparentou não estar relacionada com a idade (< 65 anos versus> 65 anos), sexo ou raça, embora a frequência de tonturas tenha sido ligeiramente superior em doentes com idade > a 75 anos. Adicionalmente, a segurança de Olsar Plus como combinação de dose elevada foi estudada em ensaios clínicos realizados em 3709 doentes que receberam olmesartan medoxomilo em combinação com hidroclorotiazida nas dosagens de 40 mg/12,5 mg e 40 mg/25 mg. As reações adversas do Olsar Plus em ensaios clínicos, estudos de segurança pós-autorização e notificações espontâneas estão resumidas em baixo, bem como as reações adversas dos componentes individuais, olmesartan medoxomilo e hidroclorotiazida, baseadas no perfil de segurança conhecido destas substâncias. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas de todas as dosagens da combinação de dose fixa de olmesartan medoxomilo e hidroclorotiazida: muito frequente (≥1/10); frequente (≥1/100 a <1 /10); pouco frequente (≥1/1.000 a <1/100); rara (≥1/10.000 a <1/1.000); muito rara (<1/10.000), desconhecido (não pode ser calculado a partir dos dados disponíveis). Infeções e infestações: Sialadenite: rara (HCTZ). Neoplasias benignas, malignas e não especificadas (incluindo quistos e pólipos): Cancro da pele não melanoma (carcinoma basocelular e carcinoma espinocelular): desconhecido (HCTZ). Doenças do sangue e do sistema linfático: Anemia aplástica: rara (HCTZ). Depressão da medula óssea: rara (HCTZ). Anemia hemolítica: rara (HCTZ). Leucopenia: rara (HCTZ). Neutropenia / Agranulocitose: rara (HCTZ). Trombocitopenia: pouco frequente (Olmesartan); rara (HCTZ). Doenças do sistema imunitário: Reações anafiláticas: pouco frequente (Olmesartan, HCTZ). Doenças do metabolismo e da nutrição: Anorexia: pouco frequente (HCTZ). Glicosúria: frequente (HCTZ). Hipercalcemia: frequente (HCTZ). Hipercolesterolemia: pouco frequente (Olsar Plus); muito frequente (HCTZ). Hiperglicemia: frequente (HCTZ). Hipercaliemia: rara (Olmesartan). Hipertrigliceridemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ). Hiperuricemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ). Hipocloremia: frequente (HCTZ). Alcalose hipoclorémica: muito rara (HCTZ). Hipocaliemia: frequente (HCTZ). Hipomagnesemia: frequente (HCTZ). Hiponatremia: frequente (HCTZ). Hiperamilasemia: frequente (HCTZ). Perturbações do foro psiquiátrico: Apatia: rara (HCTZ). Depressão: rara (HCTZ). Agitação: rara (HCTZ). Perturbações do sono: rara (HCTZ). Doenças do sistema nervoso: Estado confuso: frequente (HCTZ). Convulsões: rara (HCTZ). Perturbações de consciência (tais como perda de consciência): rara (Olsar Plus). Tonturas / Sensação de cabeça leve: frequente (Olsar Plus, Olmesartan, HCTZ). Cefaleias: frequente (Olsar Plus, Olmesartan); rara (HCTZ). Perda de apetite: pouco frequente (HCTZ). Parestesia: rara (HCTZ). Tonturas posturais: pouco frequente (Olsar Plus). Sonolência: pouco frequente (Olsar Plus). Síncope: pouco frequente (Olsar Plus). Afeções oculares: Diminuição da formação do líquido lacrimal: rara (HCTZ). Visão turva transitória: rara (HCTZ). Agravamento da miopia pré-existente: pouco frequente (HCTZ). Miopia aguda, glaucoma agudo de ângulo fechado: Desconhecido (HCTZ). Efusão coroidal: Desconhecido (HCTZ). Xantopsia: rara (HCTZ). Afeções do ouvido e do labirinto: Vertigens: pouco frequente (Olsar Plus, Olmesartan); rara (HCTZ). Cardiopatias: Angina de peito: pouco frequente (Olmesartan). Arritmias cardíacas: rara (HCTZ). Palpitações: pouco frequente (Olsar Plus). Vasculopatias: Embolia: rara (HCTZ). Hipotensão: pouco frequente (Olsar Plus); rara (Olmesartan). Angeíte necrótica (vasculite, vasculite cutânea): rara (HCTZ). Hipotensão ortostática: pouco frequente (Olsar Plus, HCTZ). Trombose: rara (HCTZ). Doenças respiratórias, torácicas e do mediastino: Bronquite: frequente(Olmesartan). Tosse: pouco frequente (Olsar Plus); frequente (Olmesartan). Dispneia: rara (HCTZ). Pneumonia intersticial: rara (HCTZ). Faringite: frequente (Olmesartan). Edema pulmonar: rara (HCTZ). Dificuldade respiratória: pouco frequente (HCTZ). Rinite: frequente (Olmesartan). Doenças gastrointestinais: Dor abdominal: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Obstipação: frequente (HCTZ). Diarreia: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Dispepsia: pouco frequente (Olsar Plus); frequente (Olmesartan). Irritação gástrica: frequente (HCTZ). Gastroenterite: frequente (Olmesartan). Meteorismo: frequente (HCTZ). Náuseas: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Pancreatite: rara (HCTZ). Ileus paralítico: muito rara (HCTZ). Vómitos: pouco frequente (Olsar Plus, Olmesartan); frequente (HCTZ). Angioedema intestinal: rara (Olmesartan). Enteropatia semelhante a esprue: Muito rara (Olmesartan).Afeções hepatobiliares: Colecistite aguda: rara (HCTZ). Icterícia (icterícia intra-hepática colestática): rara (HCTZ). Hepatite autoimune: desconhecido (olmesartan) (na experiência pós-comercialização foram reportados casos de hepatite autoimune, com período de latência de alguns meses a anos, que foram reversíveis após a descontinuação da terapêutica com olmesartan). Afeções dos tecidos cutâneos e subcutâneos: Dermatite alérgica: pouco frequente (Olmesartan). Reações anafiláticas cutâneas: rara (HCTZ). Edema angioneurótico: rara (Olsar Plus, Olmesartan). Reações do tipo lúpus eritematoso cutâneo: rara (HCTZ). Eczema: pouco frequente (Olsar Plus). Eritema: pouco frequente (HCTZ). Exantema: pouco frequente (Olmesartan). Reações de fotossensibilidade: pouco frequente (HCTZ). Prurido: pouco frequente (Olmesartan, HCTZ). Púrpura: pouco frequente (HCTZ). Erupção cutânea: pouco frequente (Olsar Plus, Olmesartan, HCTZ). Reativação de lúpus eritematoso cutâneo: rara (HCTZ). Necrólise epidérmica tóxica: rara (HCTZ). Urticária: rara (Olsar Plus); pouco frequente (Olmesartan, HCTZ). Afeções musculosqueléticas e dos tecidos conjuntivos: Artralgia: pouco frequente (Olsar Plus). Artrite: frequente (Olmesartan). Dorsalgia: pouco frequente (Olsar Plus); frequente (Olmesartan). Espasmos musculares: pouco frequente (Olsar Plus); rara (Olmesartan). Fraqueza muscular: rara (HCTZ). Mialgia: pouco frequente (Olsar Plus, Olmesartan). Dores nas extremidades: pouco frequente (Olsar Plus). Paresia: rara (HCTZ). Dor esquelética: frequente (Olmesartan). Doenças renais e urinárias: Insuficiência renal aguda: rara (Olsar Plus, Olmesartan). Hematúria: pouco frequente (Olsar Plus); frequente (Olmesartan). Nefrite intersticial: rara (HCTZ). Insuficiência renal: rara (Olmesartan). Disfunção renal: rara (HCTZ). Infeção do trato urinário: frequente (Olmesartan). Doenças dos órgãos genitais e da mama: Disfunção eréctil: Pouco frequente (Olsar Plus, HCTZ). Perturbações gerais e alterações no local de administração: Astenia: frequente (Olsar Plus); pouco frequente (Olmesartan). Dor no peito: frequente (Olsar Plus, Olmesartan). Edema facial: pouco frequente (Olmesartan). Fadiga: frequente (Olsar Plus, Olmesartan). Febre: rara (HCTZ). Sintomas do tipo gripal: frequente (Olmesartan). Letargia: rara (Olmesartan). Mal-estar: rara (Olsar Plus); pouco frequente (Olmesartan). Dor: frequente (Olmesartan). Edema periférico: Frequente (Olsar Plus, Olmesartan). Fraqueza: pouco frequente (Olsar Plus). Exames complementares de diagnóstico: Aumento da alanina aminotransferase: pouco frequente (Olsar Plus). Aumento da aspartato aminotransferase: pouco frequente (Olsar Plus). Aumento do cálcio no sangue: pouco frequente (Olsar Plus). Aumento da creatinina no sangue: pouco frequente (Olsar Plus); rara (Olmesartan), frequente (HCTZ). Aumento da creatina fosfoquinase no sangue: frequente (Olmesartan). Aumento da glucose no sangue: pouco frequente (Olsar Plus). Diminuição do hematócrito sanguíneo: rara (Olsar Plus). Diminuição da hemoglobina sanguínea: rara (Olsar Plus). Aumento dos lípidos no sangue: pouco frequente (Olsar Plus). Diminuição do potássio no sangue: pouco frequente (Olsar Plus). Aumento do potássio no sangue: pouco frequente (Olsar Plus). Aumento da ureia no sangue: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Aumento do azoto ureico sanguíneo: rara (Olsar Plus). Aumento do ácido úrico sanguíneo: rara (Olsar Plus). Aumento da gama glutamil transferase: pouco frequente (Olsar Plus). Aumento das enzimas hepáticas: frequente (Olmesartan). Foram notificados casos isolados de rabdomiólise em associação temporal com a administração de bloqueadores dos recetores da angiotensina II. Cancro da pele não-melanoma: Com base nos dados disponíveis de estudos epidemiológicos observou-se uma associação entre a HCTZ e o NMSC, dependente da dose cumulativa. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente) ou através dos seguintes contactos Direção de Gestão do Risco de Medicamentos Parque da Saúde de Lisboa, Av. Brasil 53 1749-004 Lisboa; Tel: +351 21 798 73 73; Linha do medicamento: 800222444 (gratuita); E-mail: farmacovigilancia@infarmed.pt). Informações revistas em Janeiro de 2025. Para mais informações deverá contactar o representante local do Titular da Autorização de Introdução no Mercado: A. Menarini Portugal – Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071 Paço de Arcos, Portugal. Medicamento sujeito a receita médica. Medicamento Comparticipado – Escalão B (Regime Geral 69%). Ref ª 12/2025Informações essenciais compatíveis com o RCM
NOME DO MEDICAMENTO:
Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos por película. Olsar Plus 40 mg + 25 mg, comprimidos revestidos por película.COMPOSIÇÃO QUALITATIVA E QUANTITATIVA:
Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos por película: Cada comprimido revestido por película contém 40 mg de olmesartan medoxomilo e 12,5 mg de hidroclorotiazida. Olsar Plus 40 mg + 25 mg, comprimidos revestidos por película: Cada comprimido revestido por película contém 40 mg de olmesartan medoxomilo e 25 mg de hidroclorotiazida. Excipientes com efeito conhecido: Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos por película: cada comprimido revestido por película contém 233,9 mg de lactose mono-hidratada. Olsar Plus 40 mg + 25 mg, comprimidos revestidos por película: cada comprimido revestido por película contém 221,4 mg de lactose mono-hidratada.FORMA FARMACÊUTICA:
Comprimidos revestidos por película. Olsar Plus 40 mg + 12,5 mg: comprimidos revestidos por película: comprimidos revestidos por película de cor alaranjada, forma oval, de 15 x 7 mm com C23 gravado num dos lados. Olsar Plus 40 mg + 25 mg: comprimidos revestidos por película: comprimidos revestidos por película de cor rosada, forma oval, de 15 x 7 mm com C25 gravado num dos lados.INFORMAÇÕES CLÍNICAS:
Indicações terapêuticas: Tratamento da hipertensão essencial. As combinações de dose fixa de Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg estão indicadas em doentes adultos cuja tensão arterial não está adequadamente controlada com 40 mg de olmesartan medoxomilo em monoterapia.Posologia e modo de administração: Posologia
Adultos A dose recomendada de Olsar Plus 40 mg + 12,5 mg ou 40 mg + 25 mg é de um comprimido por dia. O Olsar Plus 40 mg + 12,5 mg pode ser utilizado em doentes cuja tensão arterial não esteja adequadamente controlada com 40 mg de olmesartan medoxomilo em monoterapia. O Olsar Plus 40 mg + 25 mg pode ser utilizado em doentes cuja tensão arterial não esteja adequadamente controlada com a combinação de dose fixa de Olsar Plus 40 mg + 12,5 mg. Por conveniência, os doentes a tomar olmesartan medoxomilo e hidroclorotiazida em comprimidos separados podem mudar para Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg comprimidos contendo os componentes nas mesmas doses. O Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg pode ser tomado com ou sem alimentos. Idosos (idade igual ou superior a 65 anos) Em idosos a dosagem recomendada da combinação é idêntica à usada nos adultos. A tensão arterial deve ser monitorizada cuidadosamente. Compromisso renal O Olsar Plus está contraindicado em doentes com compromisso renal grave (depuração da creatinina < 30 ml/min). A dose máxima de olmesartan medoxomilo em doentes com compromisso renal ligeiro a moderado (depuração da creatinina de 30-60 ml/min) é de 20 mg de olmesartan medoxomilo uma vez por dia, devido à experiência limitada com doses mais elevadas neste grupo de doentes, sendo recomendada uma monitorização periódica. Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg está assim contraindicado em todos os graus de compromisso renal. Compromisso hepático O Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg deve ser usado com precaução em doentes com compromisso hepático ligeiro. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático que estão em tratamento com diuréticos e/ou outros fármacos anti-hipertensores. Em doentes com compromisso hepático moderado, a dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20 mg uma vez por dia. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave. Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg não deve ser usado em doentes com compromisso hepático moderado e grave, colestase e obstrução biliar. População pediátrica A segurança e eficácia de Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg em crianças e adolescentes com idade inferior a 18 anos não foram ainda estabelecidas. Não existem dados disponíveis.Modo de administração:
O comprimido deve ser engolido com uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser tomado à mesma hora todos os dias.Contraindicações:
Hipersensibilidade às substâncias ativas, a qualquer um dos excipientes ou a outras substâncias derivadas da sulfonamida (dado que a hidroclorotiazida é um fármaco derivado da sulfonamida). Compromisso renal. Hipocaliemia refractária, hipercalcemia, hiponatremia e hiperuricemia sintomática. Compromisso hepático moderado e grave, colestase e afeções biliares obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante de Olsar Plus com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m2).Efeitos indesejáveis:
As reações adversas mais frequentemente notificadas durante o tratamento com Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg são cefaleias (2,9%), tonturas (1,9%) e fadiga (1,0%). A hidroclorotiazida pode causar ou exacerbar uma depleção de volume que pode levar a desequilíbrio eletrolítico. A segurança do Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg foi estudada em ensaios clínicos envolvendo 3709 doentes tratados com olmesartan medoxomilo em combinação com hidroclorotiazida. Outras reações adversas relatadas com a combinação de dose fixa de olmesartan medoxomilo e hidroclorotiazida nas doses mais baixas de 20 mg + 12,5 mg e 20 mg + 25 mg podem ser potenciais reações adversas de Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg. As reações adversas do Olsar Plus em ensaios clínicos, estudos de segurança pós-autorização e notificações espontâneas estão resumidas na tabela em baixo, bem como as reações adversas dos componentes individuais, olmesartan medoxomilo e hidroclorotiazida, baseadas no perfil de segurança conhecido destas substâncias. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas: muito frequente (≥1/10); frequente (≥1/100 a <1 /10); pouco frequente (≥1/1.000 a <1/100); rara (>1/10.000 a <1 /1.000); muito rara (<1/10.000), desconhecido (não pode ser calculado a partir dos dados disponíveis). Infeções e infestações Sialadenite: rara (HCTZ). Neoplasias benignas, malignas e não especificadas (incluindo quistos e pólipos): Cancro da pele não melanoma (carcinoma basocelular e carcinoma espinocelular): desconhecido (HCTZ). Doenças do sangue e do sistema linfático Anemia aplástica: rara (HCTZ). Depressão da medula óssea: rara (HCTZ). Anemia hemolítica: rara (HCTZ). Leucopenia: rara (HCTZ). Neutropenia / Agranulocitose: rara (HCTZ). Trombocitopenia: pouco frequente (Olmesartan); rara (HCTZ). Doenças do sistema imunitário Reações anafiláticas: pouco frequente (Olmesartan, HCTZ). Doenças do metabolismo e da nutrição Anorexia: pouco frequente (HCTZ). Glicosúria: frequente (HCTZ). Hipercalcemia: frequente (HCTZ). Hipercolesterolemia: pouco frequente (Olsar Plus); muito frequente (HCTZ). Hiperglicemia: frequente (HCTZ). Hipercaliemia: rara (Olmesartan). Hipertrigliceridemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ). Hiperuricemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ). Hipocloremia: frequente (HCTZ). Alcalose hipoclorémica: muito rara (HCTZ). Hipocaliemia: frequente (HCTZ). Hipomagnesemia: frequente (HCTZ). Hiponatremia: frequente (HCTZ). Hiperamilasemia: frequente (HCTZ). Perturbações do foro psiquiátrico Apatia: rara (HCTZ). Depressão: rara (HCTZ). Agitação: rara (HCTZ). Perturbações do sono: rara (HCTZ). Doenças do sistema nervoso Estado confuso: frequente (HCTZ). Convulsões: rara (HCTZ). Perturbações de consciência (tais como perda de consciência): rara (Olsar Plus). Tonturas/Sensação de cabeça leve: frequente (Olsar Plus, Olmesartan, HCTZ). Cefaleias: frequente (Olsar Plus, Olmesartan); rara (HCTZ). Perda de apetite: pouco frequente (HCTZ). Parestesia: rara (HCTZ). Tonturas posturais: pouco frequente (Olsar Plus). Sonolência: pouco frequente (Olsar Plus). Síncope: pouco frequente (Olsar Plus). Afeções oculares Diminuição da formação do líquido lacrimal: rara (HCTZ). Visão turva transitória: rara (HCTZ). Agravamento da miopia pré-existente: pouco frequente (HCTZ). Miopia aguda, glaucoma agudo do ângulo fechado: Desconhecido (HCTZ). Efusão coroidal: Desconhecido (HCTZ). Xantopsia: rara (HCTZ). Afeções do ouvido e do labirinto Vertigens: pouco frequente (Olsar Plus, Olmesartan); rara (HCTZ). Cardiopatias Angina de peito: pouco frequente (Olmesartan). Arritmias cardíacas: rara (HCTZ). Palpitações: pouco frequente (Olsar Plus). Vasculopatias Embolismo: rara (HCTZ). Hipotensão: pouco frequente (Olsar Plus); rara (Olmesartan). Angeíte necrótica (vasculite, vasculite cutânea): rara (HCTZ). Hipotensão ortostática: pouco frequente (Olsar Plus); pouco frequente (HCTZ). Trombose: rara (HCTZ). Doenças respiratórias, torácicas e do mediastino Bronquite: frequente (Olmesartan). Tosse: pouco frequente (Olsar Plus); frequente (Olmesartan). Dispneia: rara (HCTZ). Pneumonia intersticial: rara (HCTZ). Faringite: frequente (Olmesartan). Edema pulmonar: rara (HCTZ). Dificuldade respiratória: pouco frequente (HCTZ). Rinite: frequente (Olmesartan). Síndrome da insuficiência respiratória aguda (ARDS): muito rara (HCTZ) Angioedema intestinal: rara (Olmesartan). Doenças gastrointestinais Dor abdominal: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Obstipação: frequente (HCTZ). Diarreia: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Dispepsia: pouco frequente (Olsar Plus); frequente (Olmesartan). Irritação gástrica: frequente (HCTZ). Gastroenterite: frequente (Olmesartan). Meteorismo: frequente (HCTZ). Náuseas: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Pancreatite: rara (HCTZ). Ileus paralítico: muito rara (HCTZ). Vómitos: pouco frequente (Olsar Plus, Olmesartan); frequente (HCTZ). Angioedema intestinal: rara (Olmesartan). Enteropatia semelhante a esprue: Muito rara (Olmesartan). Afeções hepatobiliares Colecistite aguda: rara (HCTZ). Icterícia (icterícia intra-hepática colestática): rara (HCTZ) Hepatite auto-imune: desconhecido (olmesartan) (na experiência pós-comercialização foram reportados casos de hepatite autoimune, com período de latência de alguns meses a anos, que foram reversíveis após a descontinuação da terapêutica com olmesartan). Afeções dos tecidos cutâneos e subcutâneos Dermatite alérgica: pouco frequente (Olmesartan). Reações anafiláticas cutâneas: rara (HCTZ). Edema angioneurótico: rara (Olsar Plus, Olmesartan). Reações do tipo lúpus eritematoso cutâneo: rara (HCTZ). Eczema: pouco frequente (Olsar Plus). Eritema: pouco frequente (HCTZ). Exantema: pouco frequente (Olmesartan). Reações de fotossensibilidade: pouco frequente (HCTZ). Prurido: pouco frequente (Olmesartan, HCTZ). Púrpura: pouco frequente (HCTZ). Erupção cutânea: pouco frequente (Olsar Plus, Olmesartan, HCTZ). Reativação de lúpus eritematoso cutâneo: rara (HCTZ). Necrólise epidérmica tóxica: rara (HCTZ). Urticária: rara (Olsar Plus); pouco frequente (Olmesartan, HCTZ). Afeções musculosqueléticas e dos tecidos conjuntivos Artralgia: pouco frequente (Olsar Plus). Artrite: frequente (Olmesartan). Dorsalgia: pouco frequente (Olsar Plus); frequente (Olmesartan). Espasmos musculares: Pouco frequente (Olsar Plus); rara (Olmesartan). Fraqueza muscular: rara (HCTZ). Mialgia: pouco frequente (Olsar Plus, Olmesartan). Dores nas extremidades: pouco frequente (Olsar Plus). Paresia: rara (HCTZ). Dor esquelética: frequente (Olmesartan). Doenças renais e urinárias Insuficiência renal aguda: rara (Olsar Plus, Olmesartan). Hematúria: pouco frequente (Olsar Plus); frequente (Olmesartan). Nefrite intersticial: rara (HCTZ). Insuficiência renal: rara (Olmesartan). Disfunção renal: rara (HCTZ). Infeção do trato urinário: frequente (Olmesartan). Doenças dos órgãos genitais e da mama Disfunção eréctil: pouco frequente (Olsar Plus, HCTZ). Perturbações gerais e alterações no local de administração Astenia: frequente (Olsar Plus); pouco frequente (Olmesartan). Dor no peito: frequente (Olsar Plus, Olmesartan). Edema facial: pouco frequente (Olmesartan). Fadiga: frequente (Olsar Plus, Olmesartan). Febre: rara (HCTZ). Sintomas do tipo gripal: frequente (Olmesartan). Letargia: rara (Olmesartan). Mal-estar: rara (Olsar Plus); pouco frequente (Olmesartan). Dor: frequente (Olmesartan). Edema periférico: frequente (Olsar Plus, Olmesartan). Fraqueza: pouco frequente (Olsar Plus). Exames complementares de diagnóstico Aumento da alanina aminotransferase: pouco frequente (Olsar Plus). Aumento da aspartato aminotransferase: pouco frequente (Olsar Plus). Aumento do cálcio no sangue: pouco frequente (Olsar Plus). Aumento da creatinina no sangue: pouco frequente (Olsar Plus); rara (Olmesartan); frequente (HCTZ). Aumento da creatina fosfoquinase no sangue: frequente (Olmesartan). Aumento da glucose no sangue: pouco frequente (Olsar Plus). Diminuição do hematócrito sanguíneo: rara (Olsar Plus). Diminuição da hemoglobina sanguínea: rara (Olsar Plus). Aumento dos lípidos no sangue: pouco frequente (Olsar Plus). Diminuição do potássio no sangue: pouco frequente (Olsar Plus). Aumento do potássio no sangue: pouco frequente (Olsar Plus). Aumento da ureia no sangue: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Aumento do azoto ureico sanguíneo: rara (Olsar Plus). Aumento do ácido úrico sanguíneo: rara (Olsar Plus). Aumento da gama glutamil transferase: pouco frequente (Olsar Plus). Aumento das enzimas hepáticas: frequente (Olmesartan). Foram notificados casos singulares de rabdomiólise em associação temporal com a toma de bloqueadores dos recetores da angiotensina II. Cancro da pele não-melanoma: Com base nos dados disponíveis de estudos epidemiológicos observou-se uma associação entre a HCTZ e o NMSC, dependente da dose cumulativa. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente) ou através dos seguintes contactos Direção de Gestão do Risco de Medicamentos Parque da Saúde de Lisboa, Av. Brasil 53 1749-004 Lisboa; Tel: +351 21 798 73 73; Linha do medicamento: 800222444 (gratuita); E-mail: farmacovigilancia@infarmed.pt). Informações revistas em Janeiro de 2025. Para mais informações deverá contactar o representante local do Titular da Autorização de Introdução no Mercado: A. Menarini Portugal – Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071 Paço de Arcos, Portugal. Medicamento sujeito a receita médica. Medicamento Comparticipado – Escalão B (Regime Geral 69%). Ref ª 10/2025Informações Essenciais Compatíveis como Resumo das Características do Medicamento
Zolnor 2 0 mg + 5 mg comprimidos revestidos por película. Cada comprimido revestido por película de Zolnor contém 20 mg de olmesartan medoxomilo e 5 mg de amlodipina (como besilato de amlodipina). Comprimido revestido por película. Cor branca, forma redonda, comprimido revestido por película de 6 mm com C73 gravado num dos lados.INFORMAÇÕES CLÍNICAS Indicações terapêuticas:
Tratamento da hipertensão essencial. Zolnor está indicado em doentes adultos cuja tensão arterial não está adequadamente controlada com olmesartan medoxomilo ou amlodipina em monoterapia.POSOLOGIA: Adultos:
A posologia recomendada de Zolnor é de um comprimido por dia. Zolnor 20 mg + 5 mg pode ser administrado em doentes cuja tensão arterial não esteja adequadamente controlada com olmesartan medoxomilo 20 mg ou amlodipina 5 mg em monoterapia. Recomenda-se a titulação gradual da dosagem dos componentes individuais antes da mudança para a combinação fixa. Quando clinicamente apropriado, pode ser considerada uma mudança direta da monoterapia para a combinação fixa. Por conveniência, os doentes a tomar olmesartan medoxomilo e amlodipina em comprimidos separados podem mudar para Zolnor comprimidos contendo os componentes nas mesmas doses. Zolnor pode ser tomado com ou sem alimentos.Idosos (idade igual ou superior a 65 anos):
Geralmente não é necessário um ajuste da dose recomendada em idosos mas aumentos da dosagem devem ser efetuados com precaução. Se for necessária a titulação para a dose máxima diária de 40 mg de olmesartan medoxomilo, a tensão arterial deve ser cuidadosamente monitorizada.Compromisso renal:
A dose máxima de olmesartan medoxomilo em doentes com compromisso renal ligeiro a moderado (depuração da creatinina 20-60 ml/min) é de 20 mg de olmesartan medoxomilo uma vez por dia, devido à experiência limitada com dosagens mais elevadas neste grupo de doentes. Não se recomenda a utilização de Zolnor em doentes com compromisso renal grave (depuração da creatinina <20 ml/min). É aconselhável a monitorização dos níveis de potássio e de creatinina em doentes com compromisso renal moderado.Compromisso hepático:
Zolnor deve ser usado com precaução em doentes com compromisso hepático ligeiro a moderado. Em doentes com compromisso hepático moderado, a dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20 mg uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático que já estão em tratamento com diuréticos e/ou outros fármacos anti-hipertensores. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave. Como acontece com todos os antagonistas dos canais de cálcio, a semivida da amlodipina é prolongada em doentes com compromisso hepático, não tendo sido estabelecidas recomendações relativas à posologia. Nestes doentes, Zolnor deve ser administrado com precaução. A farmacocinética da amlodipina não foi estudada no compromisso hepático grave. Em doentes com compromisso hepático, a amlodipina deve ser iniciada na dose mais baixa e titulada lentamente. A utilização de Zolnor em doentes com compromisso hepático grave está contraindicada.População pediátrica:
A segurança e eficácia de Zolnor em crianças e adolescentes com idade inferior a 18 anos não foram ainda estabelecidas. Não existem dados disponíveis.Modo de administração:
O comprimido deve ser engolido com uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser tomado à mesma hora todos os dias.Contraindicações:
Hipersensibilidade às substâncias ativas, aos derivados da di-hidropiridina ou a qualquer um dos excipientes. Segundo e terceiro trimestres de gravidez. Insuficiência hepática grave e obstrução biliar. O uso concomitante de Zolnor com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m 2). Devido ao componente amlodipina, o Zolnor está também contraindicado em doentes com hipotensão grave, choque (incluindo choque cardiogénico), obstrução do trato de saída do ventrículo esquerdo (por exemplo, estenose aórtica de grau elevado), insuficiência cardíaca hemodinamicamente instável após enfarte agudo do miocárdio.Efeitos indesejáveis:
As reações adversas mais frequentemente notificadas durante o tratamento com Zolnor são edema periférico (11,3%), cefaleias (5,3%) e tonturas (4,5%). As reações adversas do Zolnor em ensaios clínicos, estudos de segurança pós-autorização e notificações espontâneas estão resumidas na tabela abaixo, assim como as reações adversas dos seus componentes individuais, olmesartan medoxomilo e amlodipina, baseadas no perfil de segurança conhecido destas substâncias. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas: muito frequentes (>1/10), frequentes (>1/100, <1 /10), pouco frequentes (> 1/1.000, <1 /100), raras (>1/10.000, <1 /1.000), muito raras (<1/10.000), desconhecida (não pode ser calculado a partir dos dados disponíveis). Doenças do sangue e do sistema linfático: Leucopenia: muito rara (Amlodipina). Trombocitopenia: pouco frequente (Olmesartan), muito rara (Amlodipina). Doenças do sistema imunitário: Reacção alérgica/hipersensibilidade medicamentosa: rara (Associação olmesartan/amlodipina), muito rara (Amlodipina). Reacção anafilática: pouco frequente (Olmesartan). Doenças do metabolismo e da nutrição: Hiperglicemia: muito rara (Amlodipina). Hipercaliemia: pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan). Hipertrigliceridemia: frequente (Olmesartan). Hiperuricemia: frequente (Olmesartan). Perturbações do foro psiquiátrico: Confusão: rara (Amlodipina). Depressão: pouco frequente (Amlodipina). Insónia: pouco frequente (Amlodipina). Irritabilidade: pouco frequente (Amlodipina). Diminuição da libido: pouco frequente (Associação olmesartan/amlodipina). Alterações do humor (incluido ansiedade): pouco frequente (Amlodipina). Doenças do sistema nervoso: Tonturas: frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Disgeusia: pouco frequente (Amlodipina). Cefaleias: frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Hipertonia: muito raras (Amlodipina). Hipoestesia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Letargia: pouco frequente (Associação olmesartan/amlodipina). Parestesia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Neuropatia periférica: muito rara (Amlodipina). Tonturas posturais: pouco frequente (Associação olmesartan/amlodipina). Perturbações do sono: pouco frequente (Amlodipina). Sonolência: frequente (Amlodipina). Síncope: rara (Associação olmesartan/amlodipina), pouco frequente (Amlodipina). Tremor: pouco frequente (Amlodipina). Transtorno extrapiramidal: desconhecido (Amlodipina) Afeções oculares: Perturbações visuais (incluindo diplopia): Frequente (Amlodipina). Afecções do ouvido e do labirinto: Acufenos: pouco frequente (Amlodipina). Vertigens: pouco frequente (Associação olmesartan/amlodipina, Olmesartan). Cardiopatias: Angina de peito: pouco frequente (Olmesartan, Amlodipina (incl. agravamento da angina de peito)). Arritmia (incluindo bradicardia, taquicardia ventricular e fibrilhação auricular): pouco frequente (Amlodipina). Enfarte do miocárdio: muito rara (Amlodipina). Palpitações: pouco frequente (Associação olmesartan/amlodipina, Amlodipina) frequente (Amlodipina). Taquicardia: pouco frequente (Associação olmesartan/amlodipina). Vasculopatias: Hipotensão: pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan), pouco frequente (Amlodipina). Hipotensão ortostática: pouco frequente (Associação olmesartan/amlodipina). Rubor: rara (Associação olmesartan/amlodipina), frequente (Amlodipina). Vasculite: muito rara (Amlodipina). Doenças respiratórias, torácicas e do mediastino: Bronquite: frequente (Olmesartan). Tosse: pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan), pouco frequente (Amlodipina). Dispneia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Faringite: frequente (Olmesartan). Rinite: frequente (Olmesartan), pouco frequente (Amlodipina). Doenças gastrointestinais: Dor abdominal: frequente (Olmesartan, Amlodipina). Alteração dos hábitos intestinais (incluindo diarreia e obstipação): frequente (Amlodipina). Obstipação: pouco frequente (Associação olmesartan/amlodipina). Diarreia: pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan). Xerostomia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Dispepsia: pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan), frequente (Amlodipina). Gastrite: muito rara (Amlodipina). Gastroenterite: frequente (Olmesartan). Hiperplasia gengival: muito rara (Amlodipina). Náuseas: pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan, Amlodipina). Pancreatite: muito rara (Amlodipina). Dor abdominal superior: pouco frequente (Associação olmesartan/amlodipina). Vómitos: pouco frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Angioedema intestinal: rara (Olmesartan). Enteropatia semelhante a esprue: muito rara (Olmesartan). Afeções hepatobiliares: Enzimas hepáticas elevadas: frequente (Olmesartan), muito rara (principalmente consistentes com um quadro de colestase) (Amlodipina). Hepatite: muito rara (Amlodipina). Icterícia: muito rara (Amlodipina). Afeções dos tecidos cutâneos e subcutâneas: Alopécia: pouco frequente (Amlodipina). Edema angioneurótico: rara (Olmesartan), muito rara (Amlodipina). Dermatite alérgica: pouco frequente (Olmesartan). Eritema multiforme: muito rara (Amlodipina). Exantema: pouco frequente (Olmesartan, Amlodipina). Dermatite exfoliativa: muito rara (Amlodipina). Hiperhidrose: pouco frequente (Amlodipina). Fotosensibilidade: muito rara (Amlodipina). Prurido: pouco frequente (Olmesartan, Amlodipina). Púrpura: pouco frequente (Amlodipina). Edema de Quincke: muito rara (Amlodipina). Erupção cutânea: pouco frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Descoloração da pele: pouco frequente (Amlodipina). Síndrome de Stevens-Johnson: muito rara (Amlodipina). Necrólise epidérmica tóxica: desconhecido (Amlodipina) Urticária: rara (Associação olmesartan/amlodipina), pouco frequente (Olmesartan), pouco frequente (Amlodipina). Afecções musculosqueléticas e dos tecidos conjuntivos: Edema dos tornozelos: frequente (Amlodipina). Artralgia: Pouco frequente (Amlodipina). Artrite: frequente (Olmesartan). Dorsalgias: pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan), pouco frequente (Amlodipina). Espasmos musculares: pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan), frequente (Amlodipina). Mialgia: pouco frequente (Olmesartan, Amlodipina). Dores nas extremidades: pouco frequente (Associação olmesartan/amlodipina). Dor esquelética: frequente (Olmesartan). Doenças renais e urinárias: Insuficiência renal aguda: rara (Olmesartan). Hematúria frequente (Olmesartan). Aumento da frequência urinária: pouco frequente (Amlodipina). Perturbações da micção: pouco frequente (Amlodipina). Nictúria: pouco frequente (Amlodipina). Polaquiúria: pouco frequente (Associação olmesartan/amlodipina). Insuficiência renal: rara (Olmesartan). Infecção do tracto urinário: frequente (Olmesartan). Doenças dos órgãos genitais e da mama: Disfunção eréctil/impotência: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Ginecomastia: pouco frequente (Amlodipina). Perturbações gerais e alterações no local de administração: Astenia: pouco frequente (Associação olmesartan/amlodipina, Olmesartan), frequente (Amlodipina). Dor torácica: frequente (Olmesartan), pouco frequente (Amlodipina). Edema facial: rara (Associação olmesartan/amlodipina), pouco frequente (Olmesartan). Fadiga: frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Sintomas do tipo gripal: frequente (Olmesartan). Letargia: rara (Olmesartan). Mal-estar: pouco frequente (Olmesartan, Amlodipina). Edema: frequente (Associação olmesartan/amlodipina), muito frequente (Amlodipina). Dor: frequente (Olmesartan), pouco frequente (Amlodipina). Edema periférico: frequente (Associação olmesartan/amlodipina, Olmesartan). Edema “pitting”: frequente (Associação olmesartan/amlodipina). Exames complementares de diagnóstico: Aumento da creatinina no sangue: pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan). Aumento da creatina-fosfoquinase no sangue: frequente (Olmesartan). Diminuição do potássio no sangue: pouco frequente (Associação olmesartan/amlodipina). Aumento da ureia no sangue: frequente (Olmesartan). Aumento do ácido úrico no sangue: pouco frequente (Associação olmesartan/amlodipina). Aumento da gama glutamil transferase: pouco frequente (Associação olmesartan/amlodipina). Diminuição de peso: pouco frequente (Amlodipina). Aumento de peso: pouco frequente (Amlodipina). Foram notificados casos singulares de rabdomiólise em associação temporal com a toma de bloqueadores dos recetores da angiotensina II. Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente); Tel: +351 21 798 73 73; Linha do Medicamento: 800222444 (gratuita); Fax: + 351 21 798 73 97; E-mail: farmacovigilancia@infarmed.ptTitular da Autorização de Introdução no Mercado
(A.I.M.): Menarini International Operations Luxembourg S.A., 1, Avenue de la Gare, L-1611 Luxembourg _ Luxemburgo. Representante Local do Titular da A.I.M.: A. Menarini Portugal – Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071 Paço de Arcos, Portugal, Tel: +351 210 935 500. Informações revistas em Janeiro de 2025. Para mais informações deverá contactar o representante local doTitular da Autorização de Introdução no Mercado:
A. Menarini Portugal – Farmacêutica, S.A. Medicamento sujeito a receita médica. Escalão B (Regime Geral 69%). Refª. 10/2025Informações Essenciais Compatíveis com o RCM
NOME DO MEDICAMENTO
Zolnor HCT 20 mg + 5 mg + 12,5 mg comprimidos revestidos por películaCOMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido revestido por película de Zolnor HCT contém 20 mg de olmesartan medoxomilo, 5 mg de amlodipina (como besilato de amlodipina) e 12,5 mg de hidroclorotiazida.FORMA FARMACÊUTICA
Comprimido revestido por película. Cor laranja clara, forma redonda, comprimido revestido por película de 8 mm com C51 gravado num dos lados.INFORMAÇÕES CLÍNICAS Indicações terapêuticas:
Tratamento da hipertensão essencial. Terapêutica adjuvante: Zolnor HCT está indicado em doentes adultos cuja tensão arterial não está adequadamente controlada com a combinação olmesartan medoxomilo e amlodipina tomados através de uma formulação de dois componentes. Terapêutica de substituição: Zolnor HCT está indicado como terapêutica de substituição em doentes adultos cuja tensão arterial está adequadamente controlada com a combinação olmesartan medoxomilo, amlodipina e hidroclorotiazida, tomados através de uma formulação com dois componentes (olmesartan medoxomilo e amlodipina ou olmesartan modoxomilo e hidroclorotiazida) e uma formulação de um componente (hidroclorotiazida ou amlodipina).Posologia: Adultos:
A posologia recomendada de Zolnor HCT é de um comprimido por dia. Terapêutica adjuvante: Zolnor HCT 20 mg + 5 mg + 12,5 mg pode ser administrado em doentes cuja tensão arterial não está adequadamente controlada com olmesartan medoxomilo 20 mg e amlodipina 5 mg tomados através de uma formulação de dois componentes. Recomenda-se a titulação gradual da dose dos componentes individuais antes da mudança para a combinação tripla. Quando clinicamente apropriado pode ser considerada uma mudança direta da formulação de dois componentes para a combinação tripla. Terapêutica de substituição: Os doentes controlados com doses estáveis de olmesartan medoxomilo, amlodipina e hidroclorotiazida tomados ao mesmo tempo, através de uma formulação com dois componentes (olmesartan medoxomilo e amlodipina ou olmesartan medoxomilo e hidroclorotiazida) e uma formulação de um componente (hidroclorotiazida ou amlodipina) podem mudar para Zolnor HCT contendo os componentes nas mesmas doses. A dose máxima de Zolnor HCT é de 40 mg + 10 mg + 25 mg por dia.Idosos (idade igual ou superior a 65 anos):
em doentes idosos é recomendada precaução, incluindo uma monitorização mais frequente da tensão arterial, particularmente com a dose máxima de Zolnor HCT de 40 mg + 10 mg + 25 mg por dia. Um aumento de dosagem em idosos deve ser efetuado com precaução. Estão disponíveis dados muito limitados sobre o uso de Zolnor HCT em doentes com idade igual ou superior a 75 anos. Recomenda-se extrema precaução, incluindo uma monitorização mais frequente da tensão arterial.Compromisso renal:
A dose máxima em doentes com compromisso renal ligeiro a moderado (depuração da creatinina 30-60 ml/min) é Zolnor HCT 20 mg + 5 mg + 12,5 mg, devido à experiência limitada com dose de 40 mg de olmesartan medoxomilo neste grupo de doentes. É aconselhável a monitorização das concentrações séricas de potássio e de creatinina em doentes com compromisso renal moderado. A utilização de Zolnor HCT em doentes com compromisso renal grave (depuração da creatinina <30 ml/min) está contraindicada.Compromisso hepático:
Zolnor HCT deve ser usado com precaução em doentes com compromisso hepático ligeiro. Em doentes com compromisso hepático moderado, a dose máxima não deve exceder Zolnor HCT 20 mg + 5 mg + 12,5 mg uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático. Como acontece com todos os antagonistas dos canais de cálcio, a semivida da amlodipina é prolongada em doentes com compromisso hepático, não tendo sido estabelecidas recomendações posológicas. Consequentemente, Zolnor HCT deve ser administrado com precaução nestes doentes. A farmacocinética da amlodipina não foi estudada no compromisso hepático grave. Em doentes com compromisso hepático, a amlodipina deve ser iniciada na dose mais baixa e titulada lentamente. A utilização de Zolnor HCT está contraindicada em doentes com compromisso hepático grave, colestase ou obstrução biliar.População pediátrica:
Zolnor HCT não é recomendado em doentes com idade inferior a 18 anos devido á ausência de dados de segurança e eficácia.Modo de administração:
O comprimido deve ser engolido com uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser tomado à mesma hora todos os dias. Zolnor HCT pode ser tomado com ou sem alimentos.Contraindicações:
Hipersensibilidade às substâncias ativas, aos derivados da di-hidropiridina ou a substâncias derivadas da sulfonamida (dado que a hidroclorotiazida é um fármaco derivado da sulfonamida) ou a qualquer dos excipientes. Compromisso renal grave. Hipocaliemia refractária, hipercalcemia, hiponatremia e hiperuricemia sintomática. Insuficiência hepática grave, colestase e afeções biliares obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante de Zolnor HCT com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m 2). Devido ao componente amlodipina, Zolnor HCT está contraindicado em doentes com: choque (incluindo choque cardiogénico), hipotensão grave, obstrução do trato de saída do ventrículo esquerdo (por exemplo, estenose aórtica de grau elevado), insuficiência cardíaca hemodinamicamente instável após enfarte agudo do miocárdio.Efeitos indesejáveis:
A segurança de Zolnor HCT foi estudada em ensaios clínicos em 7826 doentes a receber olmesartan medoxomilo em combinação com amlodipina e hidroclorotiazida. As reações adversas provenientes de ensaios clínicos, estudos de segurança pós-autorização e notificação espontânea estão resumidas na tabela 1 para Zolnor HCT bem como para os componentes individuais olmesartan medoxomilo, amlodipina e hidroclorotiazida com base no perfil de segurança conhecido de cada componente individual. As reações adversas notificadas mais frequentemente durante o tratamento com Zolnor HCT são edema periférico, cefaleias e tonturas. Foi utilizada a seguinte terminologia para classificar a ocorrência de efeitos indesejáveis: muito frequentes (≥1/10), frequentes (≥1/100, <1 /10), pouco frequentes (≥1/1.000, <1/100), raros (≥1/10.000, <1/1.000), muito raros (<1/10.000), desconhecida (não pode ser calculado a partir dos dados disponíveis). * Na experiência
pós-comercialização
foram reportados
casos de
hepatite
autoimune, com
período de
latência de
alguns meses a
anos, que foram
reversíveis após
a descontinuação
da terapêutica
com
olmesartan.
* Na experiência
pós-comercialização
foram reportados
casos de
hepatite
autoimune, com
período de
latência de
alguns meses a
anos, que foram
reversíveis após
a descontinuação
da terapêutica
com
olmesartan.